题目内容
13.在容积不变的密闭容器中,可逆反应H2(g)+I2(g)?2HI(g)达到平衡的标志( )| A. | H2、I2、HI的浓度之比1:1:2 | |
| B. | H2、I2、HI的浓度保持不变 | |
| C. | 混合气体的密度保持不变 | |
| D. | 容器内气体的总压强不随时间变化而变化 |
分析 可逆反应H2(g)+I2(g)?2HI(g)达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,注意该反应为气体体积不变的反应,压强始终不变.
解答 解:A.平衡时各物质的物质的量浓度之比取决于物质的起始浓度和转化率,则各物质的物质的量浓度之比不能作为判断是否达到平衡状态的依据,故A错误;
B.H2、I2、HI的浓度保持不变,说明正逆反应速率相等,该反应达到平衡状态,故B正确;
C.该反应前后都是气体,气体的质量始终不变,而容器容积不变,则气体的密度始终不变,不能根据密度判断平衡状态,故C错误;
D.反应前后气体的体积不变,故混合气体的压强不再变化不能作为判断是否达到化学平衡状态的依据,故D错误,
故选B.
点评 本题考查了化学平衡状态的判断,题目难度不大,明确化学平衡状态的概念及特征为解答关键,注意该反应为气体体积不变的可逆反应,反应过程中气体压强、密度始终不变,为易错点.

练习册系列答案
相关题目
3.如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(气体在同温同压下测定).
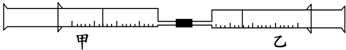
试回答下列问题:
(1)实验1中,沉淀最终变为红褐色色,写出生成白色沉淀的离子方程式:Fe2++2NH3.H2O=Fe(OH)2↓+2NH4+.
(2)实验2中,甲中最后剩余的无色气体是NO,写出NO2与H2O反应的化学方程式3NO2+H2O═2HNO3+NO.
(3)实验3中,已知:3Cl2+2NH3═N2+6HCl.甲针筒除活塞有移动,针筒内有白烟产生外,气体的颜色变化为黄绿色变为无色,最后针筒内剩余气体的体积约为5mL.

| 实验序号 | 甲针筒内物质 | 乙针筒内物质 | 甲针筒 的现象 |
| 1 | 10mL FeSO4溶液 | 10mL NH3 | 生成白色沉淀,后变色 |
| 2 | 30mL NO2 | 10mL H2O(l) | 剩无色气体 |
| 3 | 15mL Cl2 | 40mL NH3 |
(1)实验1中,沉淀最终变为红褐色色,写出生成白色沉淀的离子方程式:Fe2++2NH3.H2O=Fe(OH)2↓+2NH4+.
(2)实验2中,甲中最后剩余的无色气体是NO,写出NO2与H2O反应的化学方程式3NO2+H2O═2HNO3+NO.
(3)实验3中,已知:3Cl2+2NH3═N2+6HCl.甲针筒除活塞有移动,针筒内有白烟产生外,气体的颜色变化为黄绿色变为无色,最后针筒内剩余气体的体积约为5mL.
4.下列说法错误的是( )
| A. | 催化剂可以改变化学反应速率 | |
| B. | 食物放在冰箱中会减慢食物变质的速率 | |
| C. | 2molSO2与 1molO2一定能生成2molSO3 | |
| D. | 锌与稀硫酸反应时,加入少量铜粉能加快反应 |
1.常温下,下列各组离子一定能大量共存的是( )
| A. | 滴加石蕊显红色的溶液中:Na+、Fe2+、Cl-、NO3- | |
| B. | [H+]=10-12 mol•L-1的溶液:K+、Ba2+、Cl-、Br- | |
| C. | [OH-]/[H+]=1012的溶液中:NH4+、Al3+、NO3-、CO32- | |
| D. | 由水电离的[H+]=1.0×10-13 mol•L-1的溶液中:K+、NH4+、AlO2-、HCO3- |
8.下列有机分子中,所有原子不可能处于同一平面的是( )
| A. | H2C=CH-CN | B. | H2C=CH-CH=CH2 | C. |  | D. |  |
18.已知:充分燃烧a g乙炔(C2H2)气体时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则表示乙炔燃烧热的热化学方程式正确的是( )
| A. | C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l);△H=-2b kJ•mol-1 | |
| B. | 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);△H=-4b kJ•mol-1 | |
| C. | 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(g);△H=-4b kJ•mol-1 | |
| D. | 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);△H=b kJ•mol-1 |
2.25℃时,水中存在平衡:H2O?H++OH-△H>0,下列叙述正确的是( )
| A. | 加入稀氨水,平衡逆向移动,c(OH-)降低,Kw不变 | |
| B. | 加入少量固体CuSO4,c (H+)增大,Kw不变 | |
| C. | 加入少量固体CH3COONa,平衡逆向移动,c (H+)降低,Kw不变 | |
| D. | 加热到90℃,Kw增大,溶液仍呈中性,pH不变 |
 铬、铁、镍、铜等金属及其化合物在工业上有重要用途.
铬、铁、镍、铜等金属及其化合物在工业上有重要用途.