题目内容
17.U、V、W、X、Y、Z是原子序数依次增大的六种常见元素,Y的单质在W2中燃烧的产物可使品红溶液褪色,Z和W元素形成的化合物Z3W4具有磁性,U的单质在W2中可燃烧生成UW和UW2两种气体.X的单质是一种金属,该金属在UW2中燃烧生成黑白两种固体.请回答下列问题:
(1)Z元素在周期表中的位置:第四周期,第VIII族,XW的电子式是:
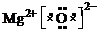 .
.(2)V、W的氢化物分子结合H+的能力较强的是(化学式):NH3>H2O,检验Z3+的常用试剂是KSCN,有关现象是:溶液变红色.
(3)YW2气体通入BaCl2和HNO3的混合液,生成白色沉淀和无色气体VW,有关的离子方程式为:3SO2+3Ba2++2H2O+2NO3-=3BaSO4↓+2NO↑+4H+.
分析 Y的单质在W2中燃烧的产物可使品红溶液褪色,该气体为SO2,则Y为S元素,W为O元素,Z和W元素形成的化合物Z3W4具有磁性,则Z3W4为Fe3O4,Z为Fe元素,U的单质在W2中燃烧可生成UW和UW2两种气体,应为CO和CO2气体,U为C元素,X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体,应为Mg和CO2的反应,则X为Mg元素,根据U、V、W、X、Y、Z是原子序数依次增大可知V为N元素,以此解答该题.
解答 解:Y的单质在W2中燃烧的产物可使品红溶液褪色,该气体为SO2,则Y为S元素,W为O元素,Z和W元素形成的化合物Z3W4具有磁性,则Z3W4为Fe3O4,Z为Fe元素,U的单质在W2中燃烧可生成UW和UW2两种气体,应为CO和CO2气体,U为C元素,X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体,应为Mg和CO2的反应,则X为Mg元素,根据U、V、W、X、Y、Z是原子序数依次增大可知V为N元素,
(1)Z为Fe元素,原子序数为26,位于元素周期表中第四周期,第VIII族,XW为MgO,为离子化合物,电子式为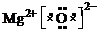 ,
,
故答案为:第四周期,第VIII族; 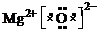 ;
;
(2)氨气为碱性气体,易与酸反应,则易结合氢离子,一般用KSCN溶液检验铁离子,可观察到溶液变为红色,
故答案为:NH3>H2O;KSCN;溶液变红色;
(4)SO2具有较强还原性,可用强氧化性物质HNO3发生氧化还原反应,生成硫酸,加入氯化钡生成硫酸钡沉淀,反应的离子方程式为:3SO2+3Ba2++2H2O+2NO3-=3BaSO4↓+2NO↑+4H+,
故答案为:3SO2+3Ba2++2H2O+2NO3-=3BaSO4↓+2NO↑+4H+.
点评 本题考查元素推断题,为高考常见题型和高频考点,侧重于学生的分析能力的考查,题目较为综合,涉及电子式、以及氧化还原反应等问题,本题的关键是正确推断元素的种类,注意把握比较问题的角度.

| A. | C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l);△H=-2b kJ•mol-1 | |
| B. | 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);△H=-4b kJ•mol-1 | |
| C. | 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(g);△H=-4b kJ•mol-1 | |
| D. | 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);△H=b kJ•mol-1 |
(1)对PM2.5样本用适量蒸馏水处理制成待测试样.测得该试样所含水溶性无机离子的化学组分及其平均浓度如表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料.
已知:H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ•mol-1
C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5kJ•mol-1
写出焦炭与水蒸气反应的热化学方程式:C(s)+H2O(g)═CO(g)+H2(g)△H=+13l.3kJ•mol-1.
②洗涤含SO2的烟气.以下物质可作为洗涤剂的是ab.
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(3)汽车尾气中NOx和CO的生成及转化:
①已知气缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H>0.
若1mol空气含0.8mol N2和0.2mol O2,1300℃时在密闭容器内反应达到平衡.测得NO的物质的量为8×10-4mol,计算该温度下的平衡常数K=4×10-6.汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是该反应为吸热反应,则温度升高,反应速率加快,平衡向吸热方向即右移动.
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g),已知该反应的△H>0,简述该设想能否实现的依据:因为该反应的△H>0,△S<0,所以任何温度下均不自发进行;
③目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为2CO+2N0 $\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.
| A. | 钠和氢气 | B. | 氯气和溴 | C. | 铝和铁 | D. | 碳和硅 |
 铬、铁、镍、铜等金属及其化合物在工业上有重要用途.
铬、铁、镍、铜等金属及其化合物在工业上有重要用途. ;
;
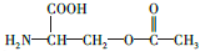 .
. .
.