题目内容
短周期元素中,X元素的阳离子和Y元素的阴离子具有相同的核外电子排布,下列叙述正确的是( )
| A、原子序数X<Y |
| B、原子半径X<Y |
| C、电子层数X=Y |
| D、离子半径X<Y |
考点:原子结构与元素的性质
专题:元素周期律与元素周期表专题
分析:X元素的阳离子和Y元素的阴离子具有相同的电子层结构,则X元素处于Y元素的下一周期,X为金属元素,最外层电子数较少,Y为非金属元素,最外层电子数相对较多,以此来解答.
解答:
解:X元素的阳离子和Y元素的阴离子具有相同的核外电子排布,则X元素处于Y元素的下一周期,X为金属元素,Y为非金属元素,
A.X在Y的下一周期,则原子序数X>Y,故A错误;
B.X在Y的下一周期,X的电子层多,则原子半径为X>Y,故B错误;
C.X在Y的下一周期,X的电子层多,则电子层数为X>Y,故C错误;
D.两种离子具有相同电子排布,原子序数大的离子半径下,则离子半径X<Y,故D正确;
故选D.
A.X在Y的下一周期,则原子序数X>Y,故A错误;
B.X在Y的下一周期,X的电子层多,则原子半径为X>Y,故B错误;
C.X在Y的下一周期,X的电子层多,则电子层数为X>Y,故C错误;
D.两种离子具有相同电子排布,原子序数大的离子半径下,则离子半径X<Y,故D正确;
故选D.
点评:本题考查原子结构与元素性质,为高频考点,明确离子具有相同的电子层结构来推断元素的位置是解答本题的关键,题目难度不大.

练习册系列答案
相关题目
下列说法正确的是( )
A、按系统命名法,有机物 可命名为3,7-二甲基-4-乙基辛烷 可命名为3,7-二甲基-4-乙基辛烷 |
| B、将1-溴丙烷和饱和氢氧化钾乙醇溶液共热,产生的气体通过酸性高锰酸钾溶液,溶液褪色,一定能证明1-溴丙烷发生了消去反应 |
C、纤维素  和壳聚糖 和壳聚糖 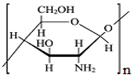 均属于多糖 均属于多糖 |
D、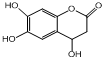 与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H6O6Na4 与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H6O6Na4 |
由硫酸钠和硫酸组成的混合液中,其c(H+)=0.2mol/L,c(SO42-)=0.3mol/L,则c(Na+)为( )
| A、0.3mol/L |
| B、0.15mol/L |
| C、0.2mol/L |
| D、0.4mol/L |
下列说法正确的是( )
| A、根据交叉分类法,Na2SO4既是钠盐又是硫酸盐 |
| B、氧化还原反应中有一种元素化合价升高,必定有另一种元素化合价降低 |
| C、根据是否有丁达尔效应将分散系分为溶液、胶体和浊液 |
| D、稀H2SO4能导电,所以稀H2SO4是电解质 |
只用一种试剂,就能把Na2S、Ba(NO3)2、NaHCO3、AlCl3、NaAlO2五种无色透明溶液区别开来,这种试剂是( )
| A、硫酸 | B、盐酸 |
| C、氨水 | D、氢氧化钠溶液 |
下列物质中,既有离子键又有非极性键的化合物是( )
| A、NH4Cl |
| B、Na2O2 |
| C、CO2 |
| D、MgCl2 |
NA表示阿伏加德罗常数.下列说法正确的是( )
| A、0.1mol Na2O2中含有的阴离子数目为0.2NA |
| B、标准状况下,2.24L CHCl3的分子数为0.1NA |
| C、标准状况下,2.24L CHCl3的分子数为0.1NA |
| D、9.2g NO2和N2O4的混合气体中含有的氮原子数为0.2NA |
取三张蓝色石蕊试纸置于表面皿上,然后按顺序滴加65%的硝酸,98.3%的硫酸和新制氯水,三张试纸最终呈现的颜色是( )
| A、白 红 白 |
| B、白 黑 白 |
| C、红 红 红 |
| D、红 黑 红 |