题目内容
下列说法正确的是( )
| A、根据交叉分类法,Na2SO4既是钠盐又是硫酸盐 |
| B、氧化还原反应中有一种元素化合价升高,必定有另一种元素化合价降低 |
| C、根据是否有丁达尔效应将分散系分为溶液、胶体和浊液 |
| D、稀H2SO4能导电,所以稀H2SO4是电解质 |
考点:酸、碱、盐、氧化物的概念及其相互联系,分散系、胶体与溶液的概念及关系,氧化还原反应,电解质与非电解质
专题:物质的分类专题
分析:A.根据Na2SO4能电离出钠离子和硫酸根离子判断;
B.氧化还原反应中化合价升高和降低的元素可能是同种元素,也可能是不同元素;
C.将分散系分为溶液、胶体和浊液的根据是分散质粒子直径大小;
D.根据电解质的定义判断.
B.氧化还原反应中化合价升高和降低的元素可能是同种元素,也可能是不同元素;
C.将分散系分为溶液、胶体和浊液的根据是分散质粒子直径大小;
D.根据电解质的定义判断.
解答:
解:A.Na2SO4能电离出钠离子和硫酸根离子,是一种盐,既是钠盐又是硫酸盐,故A正确;
B.氧化还原反应中化合价升高和降低的元素可能是同种元素,也可能是不同元素,故B错误;
C.根据分散质粒子直径大小将分散系分为溶液、胶体和浊液,故C错误;
D.电解质是化合物,稀硫酸是混合物不是电解质,故D错误;
故选A.
B.氧化还原反应中化合价升高和降低的元素可能是同种元素,也可能是不同元素,故B错误;
C.根据分散质粒子直径大小将分散系分为溶液、胶体和浊液,故C错误;
D.电解质是化合物,稀硫酸是混合物不是电解质,故D错误;
故选A.
点评:本题主要考查了盐的分类,分散系、氧化还原反应、电解质等问题,难度不大.

练习册系列答案
相关题目
下列做法存在安全隐患或导致实验失败的是( )
| A、将1mol?L-1 FeCl3溶液滴入沸水中制备Fe(OH)3胶体 |
| B、氢气还原氧化铜实验中,先通氢气后加热氧化铜 |
| C、将FeCl3稀溶液加热蒸发浓缩制备FeCl3浓溶液 |
| D、用烧瓶加热液体时投入碎瓷片以防暴沸 |
钠在自然界中最主要的存在形式是( )
| A、游离态 | B、氯化钠 |
| C、硫酸钠 | D、硝酸钠 |
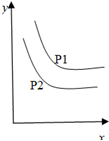 反应:L(s)+aG(g)?bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断( )
反应:L(s)+aG(g)?bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断( )| A、上述反应是放热反应 |
| B、a=b |
| C、a>b |
| D、上述反应是吸热反应 |
化工生产中常用MnS作沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s)?CuS(s)+Mn2+(aq),下列说法错误的是( )
| A、相同条件下,MnS的Ksp比CuS的Ksp大 | ||
B、该反应的平衡常数K=
| ||
| C、该反应达到平衡时c(Mn2+)=c(Cu2+) | ||
| D、往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大 |
某溶液中含有两种溶质AlCl3和H2SO4,它们的物质的量之比为2:1.用石墨做电极电解该混合溶液时,根据电极产物,可分为若干个阶段,下列叙述不正确的是( )
| A、阴极自始至终只有H2 |
| B、阳极先析出Cl2后析出O2 |
| C、电解最后阶段为电解水 |
| D、溶液中先有白色沉淀生成后沉淀全部溶解 |
短周期元素中,X元素的阳离子和Y元素的阴离子具有相同的核外电子排布,下列叙述正确的是( )
| A、原子序数X<Y |
| B、原子半径X<Y |
| C、电子层数X=Y |
| D、离子半径X<Y |
下列离子方程式正确的是( )
| A、锌粉与稀硝酸反应:Zn+2H+═Zn2++H2↑ | ||||
B、硫酸铵中NH4+的检验:NH4++OH-
| ||||
| C、NH4Al(SO4)2溶液与足量Ba(OH)2溶液混合:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3?H2O | ||||
D、浓硝酸中加入过量铁粉并加热:Fe+3NO3-+6H+
|