题目内容
由硫酸钠和硫酸组成的混合液中,其c(H+)=0.2mol/L,c(SO42-)=0.3mol/L,则c(Na+)为( )
| A、0.3mol/L |
| B、0.15mol/L |
| C、0.2mol/L |
| D、0.4mol/L |
考点:物质的量浓度
专题:物质的量浓度和溶解度专题
分析:根据溶液中阴阳离子所带的正负电荷总数相等,则有C(Na+)+C(H+)=C(SO42-)×2,据此计算.
解答:
解:根据溶液中阴阳离子所带的正负电荷总数相等,则有c(Na+)+c(H+)=c(SO42-)×2,即:
c(Na+)+0.2mol/L=0.3mol/L×2,解得:c(Na+)=0.4mol/L,
故选D.
c(Na+)+0.2mol/L=0.3mol/L×2,解得:c(Na+)=0.4mol/L,
故选D.
点评:本题主要考查溶液物质的量浓度的计算,难度不大,注意电荷守恒原则在混合溶液有关离子浓度计算经常运用.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目
下列根据反应原理设计的应用,不正确的是( )
| A、CO32-+H2O?HCO3-+OH-实验室盛放Na2CO3溶液的试剂瓶应用橡皮塞,而不用玻璃塞 |
| B、Al3++3H2O?Al(OH)3+3H+ 明矾净水 |
| C、2SbCl3+3H2O?Sb2O3+6HCl实验室可利用SbCl3的水解反应制取Sb2O3 |
| D、SnCl2+H2O?Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入氢氧化钠 |
如表是元素周期表的一部分,X、Y、Z、W均为短周期元素,X、Z的质子数之和为21.下列说法正确的是( )
| X | Y | ||
| Z | W |
| A、W元素的氢化物分子间有氢键 |
| B、Z和X能以共价键结合形成一种无机非金属材料 |
| C、Y元素的最高价氧化物的水化物是含氧酸中酸性最强的 |
| D、X元素的非金属性比Y元素非金属性强 |
钠在自然界中最主要的存在形式是( )
| A、游离态 | B、氯化钠 |
| C、硫酸钠 | D、硝酸钠 |
下列变化过程中△H<0的是( )
| A、电解Al2O3得到Al和O2 |
| B、HCl分解为H2和Cl2 |
| C、焦碳与水蒸气反应 |
| D、Na与水反应 |
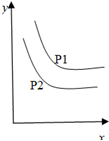 反应:L(s)+aG(g)?bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断( )
反应:L(s)+aG(g)?bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断( )| A、上述反应是放热反应 |
| B、a=b |
| C、a>b |
| D、上述反应是吸热反应 |
化工生产中常用MnS作沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s)?CuS(s)+Mn2+(aq),下列说法错误的是( )
| A、相同条件下,MnS的Ksp比CuS的Ksp大 | ||
B、该反应的平衡常数K=
| ||
| C、该反应达到平衡时c(Mn2+)=c(Cu2+) | ||
| D、往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大 |
短周期元素中,X元素的阳离子和Y元素的阴离子具有相同的核外电子排布,下列叙述正确的是( )
| A、原子序数X<Y |
| B、原子半径X<Y |
| C、电子层数X=Y |
| D、离子半径X<Y |
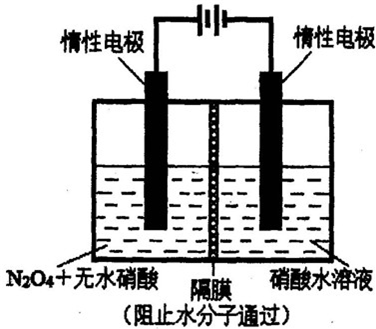 N2O5是一种新型硝化剂,其性质和制备受到人们的关注.
N2O5是一种新型硝化剂,其性质和制备受到人们的关注.