题目内容
13.Ⅰ和Ⅱ均正确并且有因果关系的是( )| 选项 | 叙述I | 叙述II |
| A | Na2S有强还原性 | 用于除去废水中的Cu2+和Hg2+ |
| B | 浓H2SO4有强氧化性 | 浓H2SO4可用于干燥SO2 |
| C | NaHCO3溶于水完全电离 | NaHCO3是强电解质 |
| D | Cl2具有酸性 | Cl2可与石灰乳或烧碱反应制备含氯消毒剂 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.依据硫离子与铜离子、汞离子反应生成硫化铜、硫化汞沉淀解答;
B.依据浓硫酸的吸水性解答;
C.水溶液中能完全电离的电解质为强电解质;
D.氯气不具有酸性.
解答 解:A.Na2S用于除去废水中的Cu2+和Hg2+,是因为硫离子与铜离子、汞离子反应生成硫化铜、硫化汞沉淀,发生复分解反应,不体现Na2S有强还原性,故A错误;
B.浓H2SO4可用于干燥SO2,是因为浓硫酸具有吸水性,与强氧化性无关,故B错误;
C.NaHCO3溶于水完全电离,所以NaHCO3是强电解质,故C正确;
D.氯气不具有酸性,故D错误;
故选:C.
点评 本题考查了物质的性质与用途,主要是硫化钠、浓硫酸、碳酸氢钠、氯气等物质性质的理解应用,注意电解质强弱的判断依据,注意知识的积累,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.下列关于离子共存或离子反应的说法正确的是( )
| A. | 某无色溶液中可能大量存在:H+、Cl-、MnO${\;}_{4}^{-}$ | |
| B. | 室温下由水电离的 c(OH-)=1×10-12mol•L-1的溶液中能大量共存:K+、Na+、Cl-、HCO3- | |
| C. | 向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2═2 Fe3++2 Br2+6 Cl- | |
| D. | 稀硫酸和Ba(OH)2溶液反应:H++SO${\;}_{4}^{2-}$+Ba2++OH-═BaSO4↓+H2O |
4.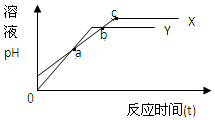 分别向等体积1mol/L盐酸和1mol/L醋酸溶液中加入等量的镁条,反应时间与溶液pH变化关系如图.下列说法中不正确的是( )
分别向等体积1mol/L盐酸和1mol/L醋酸溶液中加入等量的镁条,反应时间与溶液pH变化关系如图.下列说法中不正确的是( )
 分别向等体积1mol/L盐酸和1mol/L醋酸溶液中加入等量的镁条,反应时间与溶液pH变化关系如图.下列说法中不正确的是( )
分别向等体积1mol/L盐酸和1mol/L醋酸溶液中加入等量的镁条,反应时间与溶液pH变化关系如图.下列说法中不正确的是( )| A. | Y代表盐酸与镁条的反应 | B. | a点时反应Y消耗镁条的量少 | ||
| C. | b点表示此时两溶液pH相等 | D. | c点表示此时反应结束 |
1.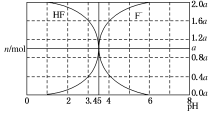 25℃时,用 2a mol•L-1 NaOH 溶液滴定 1.0L 2a mol•L-1氢氟酸溶液,得到混合液中 HF、F-的物质的量与溶液 pH 的变化如图所示.下列说法正确的是( )
25℃时,用 2a mol•L-1 NaOH 溶液滴定 1.0L 2a mol•L-1氢氟酸溶液,得到混合液中 HF、F-的物质的量与溶液 pH 的变化如图所示.下列说法正确的是( )
 25℃时,用 2a mol•L-1 NaOH 溶液滴定 1.0L 2a mol•L-1氢氟酸溶液,得到混合液中 HF、F-的物质的量与溶液 pH 的变化如图所示.下列说法正确的是( )
25℃时,用 2a mol•L-1 NaOH 溶液滴定 1.0L 2a mol•L-1氢氟酸溶液,得到混合液中 HF、F-的物质的量与溶液 pH 的变化如图所示.下列说法正确的是( )| A. | pH=3 时,溶液中:c(Na+)>c(F-) | |
| B. | c(F-)>c(HF)时,溶液一定呈碱性 | |
| C. | pH=4 时,溶液中:c(HF)+c(Na+)+c(H+)-c(OH-)<2a mol?L-1 | |
| D. | pH=3.45 时,NaOH 溶液恰好与 HF 完全反应 |
8.下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 向某无色溶液中滴加氯水后,再滴加淀粉溶液 | 溶液变为蓝色 | 原溶液为KI溶液 |
| B | 向10mL浓度均为0.1mol/L的MgCl2和CuCl2的混合溶液中滴加一滴0.1mol/L的NaOH溶液 | 出现蓝色沉淀 | Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
| C | 向某未知溶液中滴加稀盐酸后产生无色气体,气体通入品红溶液中 | 品红溶液褪色 | 原溶液中有SO32- |
| D | 用刚洗净未干燥的容量瓶配制0.1mol/L的NaOH溶液 | 所配制的溶液浓度偏小 |
| A. | A | B. | B | C. | C | D. | D |
18.下列物质的性质和用途都正确且相关的是( )
| 性质 | 用途 | |
| A | HF溶液具有酸性 | 能用HF溶液在玻璃上刻图案 |
| B | SO2具有强还原性 | SO2常用于漂白秸秆、织物 |
| C | CuSO4具有氧化性 | CuSO4和熟石灰配波尔多液 |
| D | CH3CH2OH燃烧放出大量热量 | 酒精常作清洁能源 |
| A. | A | B. | B | C. | C | D. | D |
3.工业上以黄铁矿(FeS2)为原料,采用接触法生产硫酸的流程图如下.
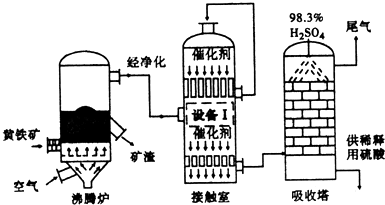
(1)黄铁矿在沸腾炉中反应的化学方程式为4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2.
(2)为充分利用反应放出的热最,接触室中应安装热交换器(填“设备I”的名称).
(3)原料气在一定条件下通人接触室中,测量各截面过程气体流中各种气体的物质的量的百分含量如下,则该过程中SO2的平衡转化率为91.7%(精确到0.1).
(4)在吸收塔中将SO3转化成硫酸,使用98.3%的硫酸从上方喷淋.而不使用水的理由是防止形成酸雾.吸收塔中填充有许多瓷管,其作用是增加SO3与浓硫酸的接触面,有利于SO3的吸收.
(5)尾气中常含有N2、O2、SO2、微量的SO3等.为了综合利用尾气,可将其通入氨水中,再按一定比例加入碳酸氢铵,降低温度析出含结晶水的晶体.已知该结晶水合物的相对分子质量为134,则其化学式为(NH4)2SO3•H2O.
(6)能用于测定硫酸尾气中SO2含量的是BC(填标号).
A.NaOH溶液、酚酞试液
B.KMnO4溶液、稀H2SO4
C.碘水、淀粉溶液
D.氨水、酚酞试液.

(1)黄铁矿在沸腾炉中反应的化学方程式为4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2.
(2)为充分利用反应放出的热最,接触室中应安装热交换器(填“设备I”的名称).
(3)原料气在一定条件下通人接触室中,测量各截面过程气体流中各种气体的物质的量的百分含量如下,则该过程中SO2的平衡转化率为91.7%(精确到0.1).
| 截面位置 含量 过程气体流 | 1(接触室人口处) | 2 | 3 | 4 |
| O2物质的量的百分含量 | 11.0% | 10.10% | 8.48% | 8.48% |
| SO2物质的量的百分含量 | 6.00% | 4.04% | 0.51% | 0.51% |
| SO3物质的量的百分含量 | 1.00% | 3.03% | 6.68% | 6.68% |
| N2物质的量的百分含量 | 81.00% | 81.83% | 83.31% | 83.31% |
(5)尾气中常含有N2、O2、SO2、微量的SO3等.为了综合利用尾气,可将其通入氨水中,再按一定比例加入碳酸氢铵,降低温度析出含结晶水的晶体.已知该结晶水合物的相对分子质量为134,则其化学式为(NH4)2SO3•H2O.
(6)能用于测定硫酸尾气中SO2含量的是BC(填标号).
A.NaOH溶液、酚酞试液
B.KMnO4溶液、稀H2SO4
C.碘水、淀粉溶液
D.氨水、酚酞试液.