题目内容
12.室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适反应条件下,它们可以按下面框图进行反应.又知E溶液是无色的,D溶液是黄色的,请回答: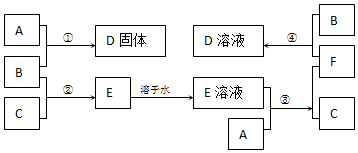
(1)A是Fe、B是Cl2、C是H2
(2)写出反应①、③、④的化学方程式
①:2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3
③:Fe+2HCl=FeCl2+H2↑
④:2FeCl2+Cl2=2FeCl3.
分析 单质B为黄绿色气体,可知B为Cl2,C为单质气体,B与C反应生成E,E溶液是无色的,则C为H2,E为HCl,A与盐酸生成氢气,A应为金属固体单质,A与盐酸反应后生成F为A的氯化物,F又能与氯气反应生成D,且A与氯气可以直接生成D,可推知A为Fe,根据转化关系可知,F为FeCl2,D为FeCl3,结合物质的相关性质解答该题.
解答 解:(1)由以上分析可知,A为Fe,B为Cl2,C为H2,
故答案为:Fe;Cl2,H2;
(2)反应①为Fe和Cl2的反应,反应的化学方程式为2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3,
反应③为Fe和HCl的反应,反应的化学方程式为Fe+2HCl=FeCl2+H2↑,
反应④为FeCl2和Cl2的反应,反应的化学方程式为2FeCl2+Cl2=2FeCl3,
故答案为:2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3;Fe+2HCl=FeCl2+H2↑;2FeCl2+Cl2=2FeCl3.
点评 本题考查无机物的推断,为高频考点,把握B为氯气及图在转化为解答的关键,侧重分析与推断能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
4.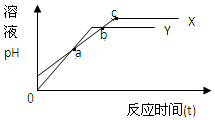 分别向等体积1mol/L盐酸和1mol/L醋酸溶液中加入等量的镁条,反应时间与溶液pH变化关系如图.下列说法中不正确的是( )
分别向等体积1mol/L盐酸和1mol/L醋酸溶液中加入等量的镁条,反应时间与溶液pH变化关系如图.下列说法中不正确的是( )
 分别向等体积1mol/L盐酸和1mol/L醋酸溶液中加入等量的镁条,反应时间与溶液pH变化关系如图.下列说法中不正确的是( )
分别向等体积1mol/L盐酸和1mol/L醋酸溶液中加入等量的镁条,反应时间与溶液pH变化关系如图.下列说法中不正确的是( )| A. | Y代表盐酸与镁条的反应 | B. | a点时反应Y消耗镁条的量少 | ||
| C. | b点表示此时两溶液pH相等 | D. | c点表示此时反应结束 |
3.工业上以黄铁矿(FeS2)为原料,采用接触法生产硫酸的流程图如下.
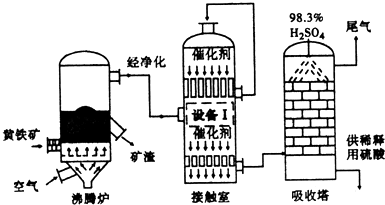
(1)黄铁矿在沸腾炉中反应的化学方程式为4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2.
(2)为充分利用反应放出的热最,接触室中应安装热交换器(填“设备I”的名称).
(3)原料气在一定条件下通人接触室中,测量各截面过程气体流中各种气体的物质的量的百分含量如下,则该过程中SO2的平衡转化率为91.7%(精确到0.1).
(4)在吸收塔中将SO3转化成硫酸,使用98.3%的硫酸从上方喷淋.而不使用水的理由是防止形成酸雾.吸收塔中填充有许多瓷管,其作用是增加SO3与浓硫酸的接触面,有利于SO3的吸收.
(5)尾气中常含有N2、O2、SO2、微量的SO3等.为了综合利用尾气,可将其通入氨水中,再按一定比例加入碳酸氢铵,降低温度析出含结晶水的晶体.已知该结晶水合物的相对分子质量为134,则其化学式为(NH4)2SO3•H2O.
(6)能用于测定硫酸尾气中SO2含量的是BC(填标号).
A.NaOH溶液、酚酞试液
B.KMnO4溶液、稀H2SO4
C.碘水、淀粉溶液
D.氨水、酚酞试液.

(1)黄铁矿在沸腾炉中反应的化学方程式为4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2.
(2)为充分利用反应放出的热最,接触室中应安装热交换器(填“设备I”的名称).
(3)原料气在一定条件下通人接触室中,测量各截面过程气体流中各种气体的物质的量的百分含量如下,则该过程中SO2的平衡转化率为91.7%(精确到0.1).
| 截面位置 含量 过程气体流 | 1(接触室人口处) | 2 | 3 | 4 |
| O2物质的量的百分含量 | 11.0% | 10.10% | 8.48% | 8.48% |
| SO2物质的量的百分含量 | 6.00% | 4.04% | 0.51% | 0.51% |
| SO3物质的量的百分含量 | 1.00% | 3.03% | 6.68% | 6.68% |
| N2物质的量的百分含量 | 81.00% | 81.83% | 83.31% | 83.31% |
(5)尾气中常含有N2、O2、SO2、微量的SO3等.为了综合利用尾气,可将其通入氨水中,再按一定比例加入碳酸氢铵,降低温度析出含结晶水的晶体.已知该结晶水合物的相对分子质量为134,则其化学式为(NH4)2SO3•H2O.
(6)能用于测定硫酸尾气中SO2含量的是BC(填标号).
A.NaOH溶液、酚酞试液
B.KMnO4溶液、稀H2SO4
C.碘水、淀粉溶液
D.氨水、酚酞试液.
7.某些建筑材料含有放射性元素氡(22286Rn).研究表明氡的α射线会致癌,WHO认定的19种致癌因素中,氡为其中之一,仅次于吸烟.该原子中中子数和质子数之差是( )
| A. | 136 | B. | 50 | C. | 86 | D. | 222 |
17.下列离子方程式表达正确的是( )
| A. | 用惰性电极电解熔融氯化钠:2Cl-+2H2O═Cl2↑+H2↑+2OH- | |
| B. | 用食醋除去水瓶中的水垢:CO32-+2CH3COOH═2CH3COO-+CO2↑+H2O | |
| C. | 用稀氢氧化钠溶液吸收二氧化氮:2OH-+2NO2═NO3-+NO↑+H2O | |
| D. | 用氢氧化钠溶液除去铝表面的氧化膜:Al2O+2OH-═2AlO2-+H2O |
2.为落实“五水共治”,某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如图流程:
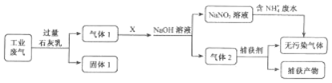
(1)固体I中主要成分为CaCO3、CaSO3、Ca(OH)2,捕获剂所捕获的气体主要是CO.
(2)处理含NH4+废水时,发生反应的离子方程式为NH4++NO2-=N2↑+2H2O.
(3)若X为适量空气,严格控制空气用量的原因是过量空气会将NO氧化成NO3-,无法与NH4+发生反应.
(4)工业废气中的SO2、NO还可采用NaClO2溶液作为吸收剂进行净化,在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323K,NaClO2溶液浓度为5×10-3mol•L-1.反应一段时间后溶液中离子浓度的分析结果如表:
①写出NaClO2溶液脱硝过程中主要反应的离子方程式3ClO2-+4NO+4OH-=4NO3-+3Cl-+2H2O.
增加压强,NO的转化率提高(填“提高”、“不变”或“降低”).
②随着吸收反应的进行,吸收剂溶液的pH逐渐减小(填“增大”、“不变”或“减小”).
③如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果.从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是Ca2+与SO42-结合生成CaSO4沉淀,使平衡向产物方向移动,SO2转化率提高.

(1)固体I中主要成分为CaCO3、CaSO3、Ca(OH)2,捕获剂所捕获的气体主要是CO.
(2)处理含NH4+废水时,发生反应的离子方程式为NH4++NO2-=N2↑+2H2O.
(3)若X为适量空气,严格控制空气用量的原因是过量空气会将NO氧化成NO3-,无法与NH4+发生反应.
(4)工业废气中的SO2、NO还可采用NaClO2溶液作为吸收剂进行净化,在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323K,NaClO2溶液浓度为5×10-3mol•L-1.反应一段时间后溶液中离子浓度的分析结果如表:
| 离子 | SO42- | SO32- | NO3- | NO2- | Cl- |
| c(mol•L-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
增加压强,NO的转化率提高(填“提高”、“不变”或“降低”).
②随着吸收反应的进行,吸收剂溶液的pH逐渐减小(填“增大”、“不变”或“减小”).
③如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果.从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是Ca2+与SO42-结合生成CaSO4沉淀,使平衡向产物方向移动,SO2转化率提高.