题目内容
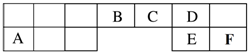
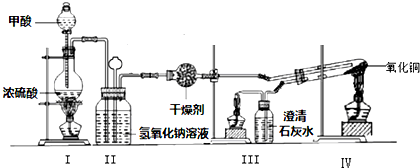
3.实验室用甲酸和浓硫酸反应制备CO,用于还原氧化铜,实验装置图和实验步骤如下:①按图连接好装置,检查装置气密性.
②点燃Ⅰ处酒精灯,缓慢滴入甲酸.
③在完成某项操作后,点燃另外两处酒精灯.
④反应结束后熄灭酒精灯,待产物冷却至室温后,收集产物.
请回答下列问题:
Ⅰ.(1)甲酸在浓硫酸条件下能分解生成CO和H2O,体现浓硫酸具有B.
A.氧化性 B.脱水性 C.吸水性
(2)NaOH溶液的作用是洗气,除去酸性气体.实验步骤③某项操作是指检验CO的纯度;
(3)若干燥管中的固体颗粒堵塞干燥管的出口,则装置Ⅱ中出现的现象为:长颈漏斗中液面上升;
(4)该实验能证明HCOOH受热产物中有CO的现象为:装置IV中黑色固体变红,装置Ⅲ中的澄清石灰水变浑浊;
(5)实验步骤④中酒精灯I、III和Ⅳ的熄灭顺序为IV、I、Ⅲ.
Ⅱ.学习小组查阅资料知:
①Cu的颜色为红色或紫红色,而Cu2O的颜色也为红色或砖红色.
②4CuO$\frac{\underline{\;灼烧\;}}{\;}$2Cu2O+O2↑
③Cu2O+2H+=Cu+Cu2++H2O
因此对CO充分还原CuO后所得红色固体是否含有Cu2O进行了认真的研究,提出下列设计方案:取该红色固体溶于足量稀硫酸中,观察溶液颜色的变化.
(6)请你评价该方案的合理性,并简述理由:
方案:合理,理由:因为Cu2O可与稀硫酸溶液反应生成Cu2+,会使溶液变蓝.
分析 (1)甲酸在浓硫酸条件下能分解生成CO和H2O,体现浓硫酸具有脱水性;
(2)氢氧化钠溶液吸收酸性气体;CO加热容易发生爆炸危险,需要排尽装置中空气,还原氧化铜之前需要检验纯度;
(3)干燥管中的固体颗粒堵塞干燥管的出口,装置Ⅱ装置气压增大,将溶液压入长颈漏斗中;
(4)若生成CO,CO与CuO反应生成Cu与二氧化碳,二氧化碳与石灰水反应生成碳酸钙沉淀;
(5)尾气中CO需要燃烧处理,还要防止石灰水倒吸;
(6)Cu与稀硫酸不反应,而Cu2O与稀硫酸反应得到Cu与硫酸铜,溶液呈蓝色.
解答 解:(1)甲酸在浓硫酸条件下能分解生成CO和H2O,体现浓硫酸具有脱水性,
故选:B;
(2)氢氧化钠溶液洗气,除去酸性气体;CO加热容易发生爆炸危险,需要排尽装置中空气,实验步骤③某项操作是指:检验CO的纯度,
故答案为:洗气,除去酸性气体;检验CO的纯度;
(3)干燥管中的固体颗粒堵塞干燥管的出口,装置Ⅱ装置气压增大,则装置Ⅱ中出现的现象为:长颈漏斗中液面上升,
故答案为:长颈漏斗中液面上升;
(4)若生成CO,CO与CuO反应生成Cu与二氧化碳,二氧化碳与石灰水反应生成碳酸钙,装置IV中黑色固体变红,装置Ⅲ中的澄清石灰水变浑浊,
故答案为:装置IV中黑色固体变红,装置Ⅲ中的澄清石灰水变浑浊;
(5)尾气中CO需要燃烧处理,还要防止石灰水倒吸,实验步骤④中酒精灯的熄灭顺序为:IV、I、Ⅲ,
故答案为:IV、I、Ⅲ;
(6)Cu与稀硫酸不反应,而Cu2O可与稀硫酸溶液反应生成Cu2+,会使溶液变蓝,观察溶液颜色的变化可以判断生成物,
故答案为:合理;因为Cu2O可与稀硫酸溶液反应生成Cu2+,会使溶液变蓝.
点评 本题考查物质制备实验,涉及对原理、装置、操作与实验方案分析评价等,注意实验中渗透环保意识与安全意识.

 阅读快车系列答案
阅读快车系列答案| A. | 平衡向正反应方向移动,逆反应速率减小 | |
| B. | 平衡常数K增大 | |
| C. | NO2的转化率变大 | |
| D. | 容器内气体颜色先变深后变浅,最后比原来还要浅 |
| 温度/℃ | 25 | T2 |
| 水的离子积常数 | 1×10-14 | 1×10-12 |
(1)T2℃时,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=9:11.此溶液中各种离子的浓度由大到小的顺序是c(Na+)>c(SO42-)>c(H+)>c(OH-);.
(2)25℃时,用0.01mol/LNaOH溶液滴定0.02mol/L 的硫酸,中和后加蒸馏水稀释到5mL,若滴定时终点判断有误差;①多加了1滴NaOH溶液②少加1滴NaOH溶液(设1滴为0.05mL),则①和②溶液中c(OH-)之比是106:1.
(3)25℃时,0.1mol/L的NaHCO3溶液的pH为8,同浓度的NaAlO2溶液的pH为11.将两种溶液等体积混合,可能发生的现象白色沉淀,其主要原因是(用离子方程式表示)HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-.
(4)已知25℃时:
| 难溶物 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 |
| Ksp | 8.0×10-16 | 8.0×10-38 | 1.0×10-17 |
| A. | ①和② | B. | 只有② | C. | ②③和④ | D. | 只有④ |
| A. | 新制氯水中加CaCO3后,溶液漂白性增强 | |
| B. | 盛有NO2、N2O4混合气体的烧瓶置于冰水中,气体颜色变浅 | |
| C. | 反应:H2(g)+I2(g)?2HI(g) 达平衡后,减小气体体积,气体颜色变深 | |
| D. | 恒温等容时,在SO2,O2和SO3的平衡体系中加入氧气,提高SO2的转化率 |
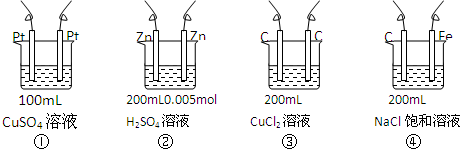
| A. | ①<②<③<④ | B. | ①<③<②<④ | C. | ②<①<④<③ | D. | ①<②<④<③ |