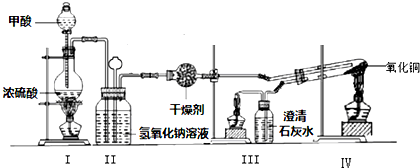
题目内容
8.工业上可以利用反应I所示原理降低污染气体的排放,并回收燃煤痼气中的硫.已知:反应I:2CO(g)+SO2(g)?2CO2(g)+S(l)△H1
反应Ⅱ:2CO2(g)?2CO(g)+O2(g)△H2=+566.0kJ•mol-1
反应Ⅲ:S(l)+O2(g)?SO2(g)△H3=-296.0kJ•mol-1
则△H1=-270kJ?mol-1.
分析 反应Ⅱ:2CO2(g)?2CO(g)+O2(g)△H2=+566.0kJ•mol-1
反应Ⅲ:S(l)+O2(g)?SO2(g)△H3=-296.0kJ•mol-1
将方程式-(Ⅱ+Ⅲ)得:2CO(g)+SO2(g)=S(s)+2CO2(g),利用盖斯定律计算△H1.
解答 解:反应Ⅱ:2CO2(g)?2CO(g)+O2(g)△H2=+566.0kJ•mol-1
反应Ⅲ:S(l)+O2(g)?SO2(g)△H3=-296.0kJ•mol-1
将方程式-(Ⅱ+Ⅲ)得:2CO(g)+SO2(g)=S(s)+2CO2(g),△H1=-[(+566.0kJ•mol-1+(-296.0KJ•mol-1)]=-270KJ•mol-1,
故答案为:-270kJ?mol-1.
点评 本题考查了盖斯定律的应用,题目难度不大,侧重于考查学生对盖斯定律的综合应用能力考查,注意运用、盖斯定律中反应热的符号,为易错点.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
18.区分下列各组物质,所加试剂或操作方法完全正确的是( )
| 需鉴别物质 | 方法1 | 方法2 | |
| A | 硫酸铵和磷矿粉 | 加水溶解 | 加熟石灰 |
| B | 一氧化碳和二氧化碳 | 闻气味 | 通过灼热的氧化铜 |
| C | 食盐水和蒸馏水 | 测pH | 蒸发结晶 |
| D | 真黄金和假黄金 (铜铝合金) | 看颜色 | 灼烧 |
| A. | A | B. | B | C. | C | D. | D |
13.关于浓度均为0.1mol•L-1的三种溶液:①醋酸溶液 ②NaOH溶液 ③醋酸钠溶液,下列说法不正确的是( )
| A. | c(CH3COO-):③>① | |
| B. | 水电离出的c(OH-):②>① | |
| C. | ①和②等体积混合后的溶液:c(OH-)=c(H+)+c(CH3COOH) | |
| D. | ①和③等体积混合后的溶液:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
20.已知次氯酸分子的结构式为H-O-Cl,下列有关说法正确的是( )
| A. | 依据其结构判断该含氧酸为强酸 | B. | O原子与H、Cl都形成σ键 | ||
| C. | 该分子为直线形非极性分子 | D. | 该分子的电子式是H:O:Cl |
18.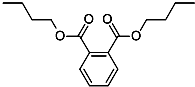 今年白酒行业塑化剂风波成为人们关注的焦点,塑化剂的其中一种邻苯二甲酸二丁酯(DBP)的结构如图所示,可由邻苯二甲酸(
今年白酒行业塑化剂风波成为人们关注的焦点,塑化剂的其中一种邻苯二甲酸二丁酯(DBP)的结构如图所示,可由邻苯二甲酸(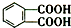 )与正丁醇发生酯化反应制得,下列有关说法不正确的是( )
)与正丁醇发生酯化反应制得,下列有关说法不正确的是( )
 今年白酒行业塑化剂风波成为人们关注的焦点,塑化剂的其中一种邻苯二甲酸二丁酯(DBP)的结构如图所示,可由邻苯二甲酸(
今年白酒行业塑化剂风波成为人们关注的焦点,塑化剂的其中一种邻苯二甲酸二丁酯(DBP)的结构如图所示,可由邻苯二甲酸(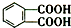 )与正丁醇发生酯化反应制得,下列有关说法不正确的是( )
)与正丁醇发生酯化反应制得,下列有关说法不正确的是( )| A. | 邻苯二甲酸二丁酯(DBP)分子式为:C16H22O4 | |
| B. | 邻苯二甲酸二丁酯(DBP)苯环上的一氯代物有4种 | |
| C. | 邻苯二甲酸二丁酯(DBP)属于乙酸乙酯的同系物 | |
| D. | 丁醇有4种不同结构,所以戊醛也有4种不同结构 |
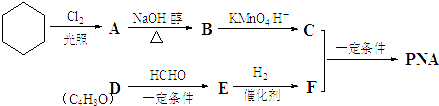
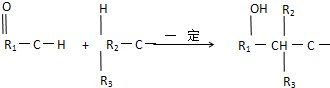 (R1、R2、R3代表烃基
(R1、R2、R3代表烃基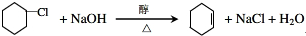 .
. .
.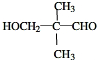 .
. .
.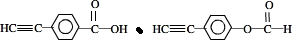 .
.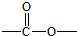 基团
基团