题目内容
12.下列事实中,不能用化学平衡移动(勒夏特列)原理解释的是( )| A. | 新制氯水中加CaCO3后,溶液漂白性增强 | |
| B. | 盛有NO2、N2O4混合气体的烧瓶置于冰水中,气体颜色变浅 | |
| C. | 反应:H2(g)+I2(g)?2HI(g) 达平衡后,减小气体体积,气体颜色变深 | |
| D. | 恒温等容时,在SO2,O2和SO3的平衡体系中加入氧气,提高SO2的转化率 |
分析 勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动,使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用.
解答 解:A.依据氯水中的化学平衡为Cl2+H2O?HCl+HClO,加入碳酸钙和盐酸反应促进平衡正向进行,次氯酸浓度增大,漂白性增强,和平衡有关,能用勒夏特利原理解释,故A不选;
B.二氧化氮和四氧化二氮混合气体的密闭容器置于冷水中,化学平衡向着生成四氧化二氮的方向进行,颜色变浅,能用勒夏特利原理解释,故B不选;
C.氢气与碘蒸气反应的平衡中,前后气体系数和是相等的,压强对平衡无影响,压缩气体,碘单质的浓度增大,颜色加深,不能用勒夏特利原理解释,故C选;
D.恒温等容时,在SO2,O2和SO3的平衡体系中加入氧气,平衡正向移动,可以用平衡移动原理解释,故D不选;
故选C.
点评 本题考查了勒夏特列原理的使用条件,难度不大,注意使用勒夏特列原理的前提必须是可逆反应.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案
相关题目
2.下列各化合物不能有化合反应生成的是( )
| A. | FeCl2 | B. | Fe(OH)3 | C. | Fe(OH)2 | D. | FeCl3 |
20.已知次氯酸分子的结构式为H-O-Cl,下列有关说法正确的是( )
| A. | 依据其结构判断该含氧酸为强酸 | B. | O原子与H、Cl都形成σ键 | ||
| C. | 该分子为直线形非极性分子 | D. | 该分子的电子式是H:O:Cl |
4.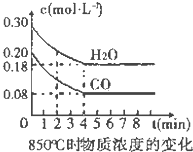 在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:
在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:
CO(g)+H2O(g)?CO2(g)+H2(g)△H<0.
(1)CO和H2O浓度变化如图,则在该温度下,该反应的平衡常数K=$\frac{c(C{O}_{2})•c({H}_{2})}{c(CO)•c({H}_{2}O)}$.0~4min的平均反应速率v(CO)=0.03 mol•L-1•min-1.若降低温度,该反应的K值将增大,该反应的化学反应速率将减小 (填“增大”“减小”或“不变”).
(2)在相同容器中发生上述反应,当温度高于850℃时,容器内各物质的浓度变化如下表.
①表中3min~4min之间反应处于平衡状态;cl数值大于0.08 mol•L-1(填大于、小于或等于).
②反应在4min~5min之间,平衡向逆方向移动,可能的原因是d.
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
(3)在相同温度下(850℃),若起始时c(CO)=1mol•L-1,C(H2O)=2mol•L-1,反应进行一段时间后,测得H2的浓度为0.5mol•L-1,则此时该反应是否达到平衡状态否(填“是”与“否”),此时v(正)>v(逆)(填“大于”“小于”或“等于”),你判断的依据是浓度商Qc=$\frac{0.5×0.5}{0.5×1.5}$=$\frac{1}{3}$,小于平衡常数K,所以平衡正向移动.
 在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:
在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0.
(1)CO和H2O浓度变化如图,则在该温度下,该反应的平衡常数K=$\frac{c(C{O}_{2})•c({H}_{2})}{c(CO)•c({H}_{2}O)}$.0~4min的平均反应速率v(CO)=0.03 mol•L-1•min-1.若降低温度,该反应的K值将增大,该反应的化学反应速率将减小 (填“增大”“减小”或“不变”).
(2)在相同容器中发生上述反应,当温度高于850℃时,容器内各物质的浓度变化如下表.
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
②反应在4min~5min之间,平衡向逆方向移动,可能的原因是d.
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
(3)在相同温度下(850℃),若起始时c(CO)=1mol•L-1,C(H2O)=2mol•L-1,反应进行一段时间后,测得H2的浓度为0.5mol•L-1,则此时该反应是否达到平衡状态否(填“是”与“否”),此时v(正)>v(逆)(填“大于”“小于”或“等于”),你判断的依据是浓度商Qc=$\frac{0.5×0.5}{0.5×1.5}$=$\frac{1}{3}$,小于平衡常数K,所以平衡正向移动.
1.下列说法正确的是( )
| A. | 过渡元素均为金属元素 | |
| B. | IA族统称为碱金属,最外层有两个电子的原子一定在IIA 族 | |
| C. | 含离子键的晶体一定是离子晶体,含共价键的晶体一定是分子晶体 | |
| D. | 两种微粒,若核外电子排布完全相同,则其化学性质一定相同 |
2.将一小块钠投入下列溶液中,既能产生气体又会出现沉淀的是( )
| A. | 稀H2SO4 | B. | 氢氧化钠溶液 | C. | NH4Cl溶液 | D. | 氯化镁溶液 |
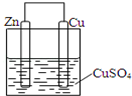 某同学设计的原电池如图所示,回答下列问题:
某同学设计的原电池如图所示,回答下列问题: