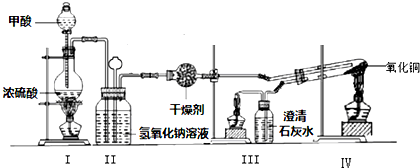
题目内容
14.500℃条件下,在恒容密闭容器中,充入1molNO2存在如下平衡2NO2(g)?N2O4(g),平衡后,向容器内再充入1molNO2,下列说法正确的( )| A. | 平衡向正反应方向移动,逆反应速率减小 | |
| B. | 平衡常数K增大 | |
| C. | NO2的转化率变大 | |
| D. | 容器内气体颜色先变深后变浅,最后比原来还要浅 |
分析 在恒容密闭容器中,可逆反应达到平衡后,向容器内再充入1molNO2,容器中气体的物质的量增大则压强增大,平衡向气体体积减小的方向移动;达到平衡时由于二氧化氮浓度比原平衡大,所以混合气体颜色加深,据此进行解答.
解答 解:A.向容器内再充入1molNO2,容器内压强增大,平衡向气体体积减小的正反应方向移动,而逆反应速率开始不变,之后逐渐增大,故A错误;
B.由于温度不变,则该反应的化学平衡常数不变,故B错误;
C.增大压强有利于平衡向正反应方向移动,所以二氧化氮的转化率增大,故C正确;
D.增大反应物浓度平衡向正反应方向移动,再次达到平衡后容器内二氧化氮浓度比第一次平衡时浓度大,所以容器内气体颜色先变深后变浅,最后比原来还要深,故D错误;
故选C.
点评 本题考查了压强对化学平衡的影响,题目难度不大,注意掌握影响化学平衡的因素,D为易错点,注意虽然二氧化氮转化率增大,但平衡时二氧化氮浓度要大于第一次平衡,所以最终颜色要比原来深.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
4.下列离子方程式错误的是( )
| A. | 将少量SO2气体通入NaClO溶液中:SO2+2ClO-+H2O═SO32-+2HClO | |
| B. | 在硫酸氢钾溶液中加入氢氧化钡溶液至pH=7 Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| C. | Na2SO3溶液使酸性KMnO4溶液褪色:5SO32-+6H++2MnO4-═5SO42-+2Mn2++3H2O | |
| D. | 向NaHCO3 溶液中滴入过量的Ba(OH)2溶液:HCO3-+Ba2++OH-═H2O+BaCO3↓ |
5.据报道,科学家发现了一种新的氢微粒,它是由三个氢原子核和二个电子构成的.关于这种氢微粒的叙述正确的是( )
| A. | 与氢气是同素异形体 | B. | 是一种新型化合物 | ||
| C. | 其中含有离子键 | D. | 能被还原成H2 |
2.下列各化合物不能有化合反应生成的是( )
| A. | FeCl2 | B. | Fe(OH)3 | C. | Fe(OH)2 | D. | FeCl3 |
9.下列说法正确的是( )
| A. | 可燃冰是一种天然气的水合物,它的开采使用有助于解决温室效应 | |
| B. | 天然食品添加剂比化学合成品安全可靠 | |
| C. | 有一种新发现的固态碳,称为“纳米泡沫”,外形似海绵,密度小,有磁性,这种碳与金刚石的关系是同素异形体 | |
| D. | 工业酒精含95%左右的乙醇,可以用于酒精饮料的勾兑,降低生产成本 |
4.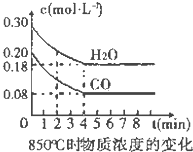 在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:
在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:
CO(g)+H2O(g)?CO2(g)+H2(g)△H<0.
(1)CO和H2O浓度变化如图,则在该温度下,该反应的平衡常数K=$\frac{c(C{O}_{2})•c({H}_{2})}{c(CO)•c({H}_{2}O)}$.0~4min的平均反应速率v(CO)=0.03 mol•L-1•min-1.若降低温度,该反应的K值将增大,该反应的化学反应速率将减小 (填“增大”“减小”或“不变”).
(2)在相同容器中发生上述反应,当温度高于850℃时,容器内各物质的浓度变化如下表.
①表中3min~4min之间反应处于平衡状态;cl数值大于0.08 mol•L-1(填大于、小于或等于).
②反应在4min~5min之间,平衡向逆方向移动,可能的原因是d.
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
(3)在相同温度下(850℃),若起始时c(CO)=1mol•L-1,C(H2O)=2mol•L-1,反应进行一段时间后,测得H2的浓度为0.5mol•L-1,则此时该反应是否达到平衡状态否(填“是”与“否”),此时v(正)>v(逆)(填“大于”“小于”或“等于”),你判断的依据是浓度商Qc=$\frac{0.5×0.5}{0.5×1.5}$=$\frac{1}{3}$,小于平衡常数K,所以平衡正向移动.
 在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:
在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0.
(1)CO和H2O浓度变化如图,则在该温度下,该反应的平衡常数K=$\frac{c(C{O}_{2})•c({H}_{2})}{c(CO)•c({H}_{2}O)}$.0~4min的平均反应速率v(CO)=0.03 mol•L-1•min-1.若降低温度,该反应的K值将增大,该反应的化学反应速率将减小 (填“增大”“减小”或“不变”).
(2)在相同容器中发生上述反应,当温度高于850℃时,容器内各物质的浓度变化如下表.
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
②反应在4min~5min之间,平衡向逆方向移动,可能的原因是d.
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
(3)在相同温度下(850℃),若起始时c(CO)=1mol•L-1,C(H2O)=2mol•L-1,反应进行一段时间后,测得H2的浓度为0.5mol•L-1,则此时该反应是否达到平衡状态否(填“是”与“否”),此时v(正)>v(逆)(填“大于”“小于”或“等于”),你判断的依据是浓度商Qc=$\frac{0.5×0.5}{0.5×1.5}$=$\frac{1}{3}$,小于平衡常数K,所以平衡正向移动.