题目内容
13.如图所示,图中四种装置工作一段时间后,测得导线上均通过了0.002mol电子,此时溶液的pH由小到大的排列顺序为(不考虑溶液的水解和溶液的体积变化)( )
| A. | ①<②<③<④ | B. | ①<③<②<④ | C. | ②<①<④<③ | D. | ①<②<④<③ |
分析 ①中析出铜和氧气,所以电解一段时间后,溶液中酸性增强,②中析出氢气,所以氢离子浓度降低,根据转移电子计算①②中氢离子浓度相对大小,比较酸性强弱,③是电解溶质本身④中阴极上析出氢气,阳极上析出氯气,导致溶液的碱性增强.
解答 解:①总电极反应式:2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+,阳极电极反应式:2H2O-4e-═4H++O2↑,通过0.002mole-,产生n(H+)=0.002mol,c(H+)=0.02mol•L-1;
②总电极反应式:Zn+2H+$\frac{\underline{\;通电\;}}{\;}$Zn2++H2↑,阴极电极反应式:2H++2e-═=H2↑,通过0.002mole-,消耗H+的物质的量为0.002mol,剩余H+的浓度:c(H$\frac{(200×1{0}^{-3}×0.005×2-0.002)}{(200×1{0}^{-3})mol•{L}^{-1}}$=0,说明H2SO4完全反应,溶质是ZnSO4;
③总电极反应式:Cu2++2Cl-$\frac{\underline{\;通电\;}}{\;}$Cu+Cl2↑,氯气和水发生极少量的盐酸和次氯酸;
④总电极反应式:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH-,溶液显碱性,
所以c(H+)的从大到小的顺序:①③②④,pH与c(H+)相反,pH由小到大的顺序①<③<②<④;
故选B.
点评 本题考查了电解池原理,明确阴阳极上放电的离子是解本题的关键,难度不大,侧重于考查学生的分析能力和计算能力.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
4.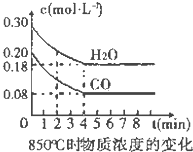 在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:
在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:
CO(g)+H2O(g)?CO2(g)+H2(g)△H<0.
(1)CO和H2O浓度变化如图,则在该温度下,该反应的平衡常数K=$\frac{c(C{O}_{2})•c({H}_{2})}{c(CO)•c({H}_{2}O)}$.0~4min的平均反应速率v(CO)=0.03 mol•L-1•min-1.若降低温度,该反应的K值将增大,该反应的化学反应速率将减小 (填“增大”“减小”或“不变”).
(2)在相同容器中发生上述反应,当温度高于850℃时,容器内各物质的浓度变化如下表.
①表中3min~4min之间反应处于平衡状态;cl数值大于0.08 mol•L-1(填大于、小于或等于).
②反应在4min~5min之间,平衡向逆方向移动,可能的原因是d.
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
(3)在相同温度下(850℃),若起始时c(CO)=1mol•L-1,C(H2O)=2mol•L-1,反应进行一段时间后,测得H2的浓度为0.5mol•L-1,则此时该反应是否达到平衡状态否(填“是”与“否”),此时v(正)>v(逆)(填“大于”“小于”或“等于”),你判断的依据是浓度商Qc=$\frac{0.5×0.5}{0.5×1.5}$=$\frac{1}{3}$,小于平衡常数K,所以平衡正向移动.
 在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:
在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0.
(1)CO和H2O浓度变化如图,则在该温度下,该反应的平衡常数K=$\frac{c(C{O}_{2})•c({H}_{2})}{c(CO)•c({H}_{2}O)}$.0~4min的平均反应速率v(CO)=0.03 mol•L-1•min-1.若降低温度,该反应的K值将增大,该反应的化学反应速率将减小 (填“增大”“减小”或“不变”).
(2)在相同容器中发生上述反应,当温度高于850℃时,容器内各物质的浓度变化如下表.
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
②反应在4min~5min之间,平衡向逆方向移动,可能的原因是d.
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
(3)在相同温度下(850℃),若起始时c(CO)=1mol•L-1,C(H2O)=2mol•L-1,反应进行一段时间后,测得H2的浓度为0.5mol•L-1,则此时该反应是否达到平衡状态否(填“是”与“否”),此时v(正)>v(逆)(填“大于”“小于”或“等于”),你判断的依据是浓度商Qc=$\frac{0.5×0.5}{0.5×1.5}$=$\frac{1}{3}$,小于平衡常数K,所以平衡正向移动.
1.下列说法正确的是( )
| A. | 过渡元素均为金属元素 | |
| B. | IA族统称为碱金属,最外层有两个电子的原子一定在IIA 族 | |
| C. | 含离子键的晶体一定是离子晶体,含共价键的晶体一定是分子晶体 | |
| D. | 两种微粒,若核外电子排布完全相同,则其化学性质一定相同 |
18.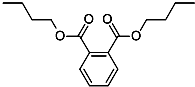 今年白酒行业塑化剂风波成为人们关注的焦点,塑化剂的其中一种邻苯二甲酸二丁酯(DBP)的结构如图所示,可由邻苯二甲酸(
今年白酒行业塑化剂风波成为人们关注的焦点,塑化剂的其中一种邻苯二甲酸二丁酯(DBP)的结构如图所示,可由邻苯二甲酸( )与正丁醇发生酯化反应制得,下列有关说法不正确的是( )
)与正丁醇发生酯化反应制得,下列有关说法不正确的是( )
 今年白酒行业塑化剂风波成为人们关注的焦点,塑化剂的其中一种邻苯二甲酸二丁酯(DBP)的结构如图所示,可由邻苯二甲酸(
今年白酒行业塑化剂风波成为人们关注的焦点,塑化剂的其中一种邻苯二甲酸二丁酯(DBP)的结构如图所示,可由邻苯二甲酸( )与正丁醇发生酯化反应制得,下列有关说法不正确的是( )
)与正丁醇发生酯化反应制得,下列有关说法不正确的是( )| A. | 邻苯二甲酸二丁酯(DBP)分子式为:C16H22O4 | |
| B. | 邻苯二甲酸二丁酯(DBP)苯环上的一氯代物有4种 | |
| C. | 邻苯二甲酸二丁酯(DBP)属于乙酸乙酯的同系物 | |
| D. | 丁醇有4种不同结构,所以戊醛也有4种不同结构 |
5.下列说法不正确的是( )
| A. | 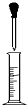 用量筒量取一定量液体时,先从试剂瓶中直接倒入大部分试剂于量筒中,至接近刻度时改用如图所示操作,逐滴加入至刻度 用量筒量取一定量液体时,先从试剂瓶中直接倒入大部分试剂于量筒中,至接近刻度时改用如图所示操作,逐滴加入至刻度 | |
| B. | 金属镁因保存不当造成失火可用细沙盖灭,不能用泡沫灭火器 | |
| C. | 探究温度对化学反应速率影响时,先将硫代硫酸钠与硫酸两种溶液混合后再用水浴加热 | |
| D. | 热化学方程式中,如果没有注明温度和压强,表示反应热是在25℃,101KPa测得的 |
2.将一小块钠投入下列溶液中,既能产生气体又会出现沉淀的是( )
| A. | 稀H2SO4 | B. | 氢氧化钠溶液 | C. | NH4Cl溶液 | D. | 氯化镁溶液 |
3.碱式氯化镁(MgOHCl)常用于塑料添加剂,工业上制备方法较多,其中利用氢氧化镁热分解氯化铵制氨气并得到碱式氯化镁的工艺属于我国首创.某科研小组同学根据该原理设计了如图实验装置来制备碱式氯化镁并探究氨的催化氧化反应,其中CuO的质量为8.0g.
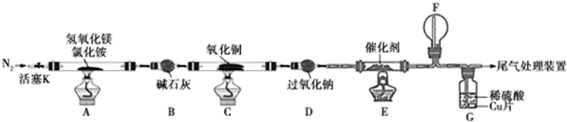
请回答下列问题:
(1)装置A中发生反应生成碱式氯化镁的化学方程式为Mg(OH)2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$MgOHCl+NH3↑+H2O.
(2)反应过程中持续通入N2的作用有两点:一是使装置A中产生的氨气完全导出,二是防止倒吸.
(3)一段时间后,你认为装置F中可观察到什么现象?生成红棕色气体.
(4)用离子方程式解释装置G中溶液变成蓝色的原因:3Cu+2NO3-+8H+=2NO↑+3Cu2++4H2O.
(5)反应完毕,装置C中的氧化铜完全反应,由黑色变为红色,称其质量为6.8g,且生成的气体可直接排放到大气中,则红色固体是Cu和Cu2O,该反应中电子转移的物质的量为0.15mol.
(6)请你设计一个实验方案,证明装置C中完全反应后的红色固体中含氧化亚铜.
已知:①Cu2O+H+=Cu2++Cu ②限选试剂:2mol/LH2SO4溶液、12mol/LH2SO4溶液、2mol/LHNO3溶液、10mol/LHNO3溶液

请回答下列问题:
(1)装置A中发生反应生成碱式氯化镁的化学方程式为Mg(OH)2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$MgOHCl+NH3↑+H2O.
(2)反应过程中持续通入N2的作用有两点:一是使装置A中产生的氨气完全导出,二是防止倒吸.
(3)一段时间后,你认为装置F中可观察到什么现象?生成红棕色气体.
(4)用离子方程式解释装置G中溶液变成蓝色的原因:3Cu+2NO3-+8H+=2NO↑+3Cu2++4H2O.
(5)反应完毕,装置C中的氧化铜完全反应,由黑色变为红色,称其质量为6.8g,且生成的气体可直接排放到大气中,则红色固体是Cu和Cu2O,该反应中电子转移的物质的量为0.15mol.
(6)请你设计一个实验方案,证明装置C中完全反应后的红色固体中含氧化亚铜.
已知:①Cu2O+H+=Cu2++Cu ②限选试剂:2mol/LH2SO4溶液、12mol/LH2SO4溶液、2mol/LHNO3溶液、10mol/LHNO3溶液
| 实验步骤 | 预期现象和结论 |
| 步骤1:取装置C中反应后的少许固体于试管中 | \ |
| 步骤2:向试管中加入2mol/LH2SO4溶液 | 液中出现蓝色,说明红色固体中含有Cu2O |

 病人输液用的葡萄糖注射液是葡萄糖(C6H12O6)的水溶液,其标签上的部分内容如图所示.利用标签所提供的信息,回答下列问题:
病人输液用的葡萄糖注射液是葡萄糖(C6H12O6)的水溶液,其标签上的部分内容如图所示.利用标签所提供的信息,回答下列问题: