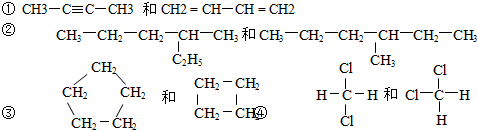题目内容
15.X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大,元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X-的半径,Y2是空气主要成分之一,请回答:(1)Q元素在周期表中的位置第三周期ⅥA族;
(2)这五种元素原子半径从大到小的顺序为Na>S>N>O>H(填元素符号)
(3)元素的非金属性Z>Q(填“>”或“<”),下列各项中,不能说明这一结论的事实有C(填序号)
A.Q的氢化物的水溶液放置在空气中会变浑浊 B.Z与Q之间形成的化合物中元素的化合价
C.Z和Q的单质的状态 D.Z和Q在周期表中的位置
(4)Q的氢化物与它的低价氧化物反应的化学方程式为H2S+H2O2=S↓+2H2O
(5)X与Y可形成分子A,也可形成阳离子B,A、B在水溶液中酸、碱性恰好相反,写出A的电子式
 ;实验室制备气体A的化学方程式2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑B的水溶液不呈中性的原因NH4++H2O?NH3.H2O+H+(用离子方程式表示)
;实验室制备气体A的化学方程式2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑B的水溶液不呈中性的原因NH4++H2O?NH3.H2O+H+(用离子方程式表示)(6)若使A按下列途径完全转化为F:
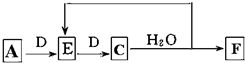
①F的化学式为HNO3;
②C→F过程中氧化剂与还原剂的物质的量之比为1:2.
分析 X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大,元素Z在地壳中含量最高,则Z为O元素;J元素的焰色反应呈黄色,则J为Na;Q的最外层电子数与其电子总数比为3:8,原子序数大于Na元素,故Q处于第三周期,则Q为S元素;X能与J形成离子化合物,且J+的半径大于X-的半径,可推知X为H元素;Y2是空气主要成分之一,则Y为N元素.
(1)主族元素周期数=电子层数、主族族序数=最外层电子数;
(2)同周期自左而右原子半径减小,电子层越多原子半径越大;
(3)同主族自上而下非金属性减弱,可利用气态氢化物的稳定性、单质之间的置换反应来、元素相互化合时化合价等说明,物质状态属于物理性质,不能比较非金属性强弱;
(4)硫化氢与过氧化氢反应生成S与水;
(5)X与Y可形成分子A,也可形成阳离子B,A、B在水溶液中酸、碱性恰好相反,A为NH3,B为NH4+,溶液中铵根离子水解,溶液呈酸性;
(6)A为NH3,与D连续反应生成C,C与水反应得到E,则D为O2,E为NO、C为NO2、F为HNO3.
解答 解:X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大,元素Z在地壳中含量最高,则Z为O元素;J元素的焰色反应呈黄色,则J为Na;Q的最外层电子数与其电子总数比为3:8,原子序数大于Na元素,故Q处于第三周期,则Q为S元素;X能与J形成离子化合物,且J+的半径大于X-的半径,可推知X为H元素;Y2是空气主要成分之一,则Y为N元素.
(1)Q为S元素,原子核外有3个电子层、最外层电子数为6,处于周期表中第三周期ⅥA族,
故答案为:第三周期ⅥA族;
(2)同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径:Na>S>N>O>H,
故答案为:Na>S>N>O>H;
(3)O、S同主族自上而下非金属性减弱,故非金属性O>S;
A.H2S的水溶液放置在空气中会变浑浊,说明氧气能氧化硫化氢生成硫,则氧气的氧化性大于S,说明O元素非金属较强,故A正确;
B.S与O元素形成的化合物中S元素表现正化合价,O元素表现负化合价,氧原子对键合电子吸引力更大,故氧元素非极性较强,故B正确;
C.单质状态属于物理性质,不能比较非金属性强弱,故C错误;
D.同主族自上而下非金属性减弱,故非金属性O>S,故D正确,
故答案为:>;C;
(4)硫化氢与过氧化氢反应生成S与水,反应方程式为:H2S+H2O2=S↓+2H2O,
故答案为:H2S+H2O2=S↓+2H2O;
(5)X与Y可形成分子A,也可形成阳离子B,A、B在水溶液中酸、碱性恰好相反,A为NH3,电子式为 ,实验室制备氨气反应方程式为:2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑,B为NH4+,溶液中铵根离子水解:NH4++H2O?NH3.H2O+H+,溶液呈酸性,
,实验室制备氨气反应方程式为:2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑,B为NH4+,溶液中铵根离子水解:NH4++H2O?NH3.H2O+H+,溶液呈酸性,
故答案为: ;2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑;NH4++H2O?NH3.H2O+H+;
;2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑;NH4++H2O?NH3.H2O+H+;
(6)A为NH3,与D连续反应生成C,C与水反应得到E,则D为O2,E为NO、C为NO2、F为HNO3.
①F的化学式为HNO3,故答案为:HNO3;
②设氨气为1mol,完全转化为硝酸,根据电子转移守恒,需要氧气$\frac{1mol×[5-(-3)]}{4}$=2mol,故整个过程中氨气与消耗氧气物质的量之比为1:2,故答案为:1:2.
点评 本题考查结构性质位置关系应用、元素化合物推断,(6)中注意利用整个过程中电子转移守恒计算,避免过程法的繁琐,难度中等.

| A. | 正极反应式为:O2+2H2O+4e-═4OH- | |
| B. | 工作一段时间后,电解液中KOH的物质的量浓度不变 | |
| C. | 该燃料电池的总反应方程式为O2+2H2═2H2O | |
| D. | 用该燃料电池CuCl2溶液,产生2.24LCl2(标况)时,有0.2mol电子转移 |
| A. | 常温常压下,11.2L CO2与8.5g NH3所含分子数相等 | |
| B. | 等质量的H3O+和OH-质子数之比与电子数之比相同 | |
| C. | 同温同压下,相同体积的H2和CO2的原子数之比为2:3 | |
| D. | 同温同压下,相同质量的NO和C2H4(气体)体积相同 |
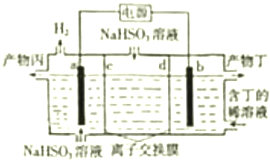
| A. | a极为阴极 | |
| B. | d为阴离子交换膜 | |
| C. | b极反应式为:HSO3-+H2O-2e-═SO42-+3H+ | |
| D. | 产物丙为硫酸溶液 |
| A. | 碘水、淀粉溶液 | B. | 溴水、汽油 | ||
| C. | 氯水、四氯化碳 | D. | 硝酸银溶液、稀硝酸 |
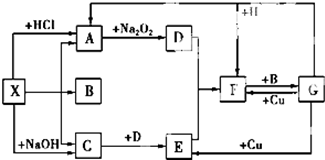 如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出.常温下X和H是固体,B和G是液体,其余均为气体,1molX分解得到A、B、C各1mol.试回答下列各题:
如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出.常温下X和H是固体,B和G是液体,其余均为气体,1molX分解得到A、B、C各1mol.试回答下列各题: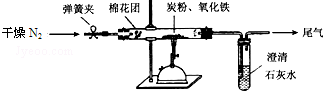
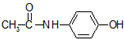 )是最常见的消炎解热镇痛药,用于治疗感冒发烧和关节痛等.M的一种合成路线如下:
)是最常见的消炎解热镇痛药,用于治疗感冒发烧和关节痛等.M的一种合成路线如下:
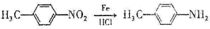 .
. ;
; ;
; ;
; .
.