题目内容
3.氢氧燃料电池以KOH溶液为电解质溶液,下列有关该电池的叙述不正确的是( )| A. | 正极反应式为:O2+2H2O+4e-═4OH- | |
| B. | 工作一段时间后,电解液中KOH的物质的量浓度不变 | |
| C. | 该燃料电池的总反应方程式为O2+2H2═2H2O | |
| D. | 用该燃料电池CuCl2溶液,产生2.24LCl2(标况)时,有0.2mol电子转移 |
分析 氢氧燃料碱性电池中,通入氢气的一极为电池的负极,发生氧化反应,电极反应式为H2-2e-+2OH-=2H2O,通入氧气的一极为电池的正极,发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,反应的总方程式为2H2+O2=2H2O,结合氯气和转移电子之间的关系式计算.
解答 解:A.正极上氧气得电子发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,故A正确;
B.负极上氢气和氢氧根离子反应生成水,正极上氧气得电子和水反应生成氢氧根离子,所以溶液中钾离子没有参与反应,根据原子守恒知,KOH的物质的量不变浓度变大,故B错误;
C.负极电极反应式为H2-2e-+2OH-=2H2O,正极电极反应式为O2+2H2O+4e-=4OH-,反应的总方程式为2H2+O2=2H2O,故C正确;
D.n(Cl2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,根据化合价可知转移电子0.2mol,故D正确.
故选B.
点评 本题考查了化学电源新型电池,根据正负极上得失电子确定电极,再结合电解质溶液酸碱性书写电极反应式,如果电解质溶液呈酸性,则正负极电极反应就改变,为易错点,题目难度中等.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
1.下列物质的贮存方法不正确的是( )
| A. | 新制氯水应保存在棕色瓶中 | B. | 少量金属钠保存在煤油中 | ||
| C. | 漂白粉可露置于空气中保存 | D. | 液溴采用液封法保存 |
19.下列说法正确的是( )
| A. | 25℃时NH4Cl溶液的Kw大于100℃时NH4Cl溶液的Kw | |
| B. | SO2通入碘水中,反应的离子方程式为SO2+I2+2H2O═SO42-+2I- | |
| C. | 加入铝粉能产生氢气的溶液中,可能存在大量的Na+、Ba2+、AlO2-、NO3- | |
| D. | 100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液呈中性 |
6.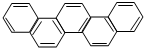 2015年,北京正在申办冬奥会.有一种有机物因其酷似奥林克五环旗,科学家称其为奥林匹克烃,下列有关奥匹克烃的说中正确的是( )
2015年,北京正在申办冬奥会.有一种有机物因其酷似奥林克五环旗,科学家称其为奥林匹克烃,下列有关奥匹克烃的说中正确的是( )
 2015年,北京正在申办冬奥会.有一种有机物因其酷似奥林克五环旗,科学家称其为奥林匹克烃,下列有关奥匹克烃的说中正确的是( )
2015年,北京正在申办冬奥会.有一种有机物因其酷似奥林克五环旗,科学家称其为奥林匹克烃,下列有关奥匹克烃的说中正确的是( )| A. | 该物质属于苯的同系物 | |
| B. | 该物质的一氯代物有一种 | |
| C. | 该物质完全燃烧生成水的物质的量小于二氧化碳的物质的量 | |
| D. | 该物质的分子中只含有非极性键 |
13.甲溶液:氨水质量分数为1%的溶液与9%的溶液等体积混合;乙溶液:硝酸质量分数为1%的溶液与9%的溶液等体积混合;丙溶液:硫酸质量分数为1%的溶液与9%的溶液等质量混合.则下列叙述正确的是( )
| A. | 甲、乙、丙溶液中溶质的质量分数均大于5% | |
| B. | 甲溶液中溶质的质量分数小于5%,乙、丙溶液中溶质的质量分数大于5% | |
| C. | 甲溶液中溶质的质量分数小于5%,乙的大于5%,丙的等于5% | |
| D. | 甲、乙、丙溶液中溶质的质量分数均等于5% |
 ; B的结构简式CH3CH2CHO;B的物质的量0.06mol;
; B的结构简式CH3CH2CHO;B的物质的量0.06mol; .
.
 ;实验室制备气体A的化学方程式2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑B的水溶液不呈中性的原因NH4++H2O?NH3.H2O+H+(用离子方程式表示)
;实验室制备气体A的化学方程式2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑B的水溶液不呈中性的原因NH4++H2O?NH3.H2O+H+(用离子方程式表示)