题目内容
采用32%~35%的FeCl3溶液腐蚀印刷线路板上的金属铜,腐蚀废液中主要含有CuCl2、FeCl2和HCl等溶质.
(1)用FeCl3溶液溶解印刷线路板上金属铜的化学方程式为 .
(2)工业上用铁粉回收腐蚀废液中的铜,方法如下:
①用铁粉回收铜的操作为:加入过量铁粉,充分搅拌,过滤、 、 、洗涤、 .
②科学家对铁置换铜的工艺有如下研究:
分别在a、b、c三种条件下回收腐蚀废液中的铜,取充分反应后的粉末各3.000g分别放入甲、乙、丙三个烧杯中,再加入100mL 0.5mol?L-1的硫酸,水浴加热(70℃),搅拌,进行除铁处理.分别在第10、20、30、40、50min时,用吸管移取0.5g左右的铜试样于试管内,测定铜粉中铁的含量(质量分数),其结果如图所示.
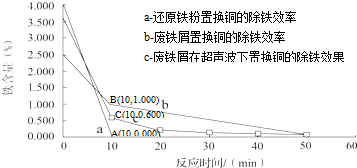
你认为除铁效果最好的是 (填“a”、“b”或“c”),其原因是 .
(3)工业上可用腐蚀废液制备CuCl2?2H2O,从而进行对废液的利用,其工艺流程如下:
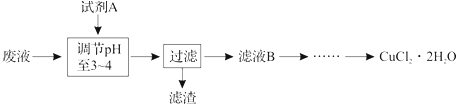
部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
试剂A最好应选用 (填写字母代号),理由是 .
a.浓硫酸 b.Cl2 c.NaClO d.NaOH溶液.
(1)用FeCl3溶液溶解印刷线路板上金属铜的化学方程式为
(2)工业上用铁粉回收腐蚀废液中的铜,方法如下:
①用铁粉回收铜的操作为:加入过量铁粉,充分搅拌,过滤、
②科学家对铁置换铜的工艺有如下研究:
分别在a、b、c三种条件下回收腐蚀废液中的铜,取充分反应后的粉末各3.000g分别放入甲、乙、丙三个烧杯中,再加入100mL 0.5mol?L-1的硫酸,水浴加热(70℃),搅拌,进行除铁处理.分别在第10、20、30、40、50min时,用吸管移取0.5g左右的铜试样于试管内,测定铜粉中铁的含量(质量分数),其结果如图所示.

你认为除铁效果最好的是
(3)工业上可用腐蚀废液制备CuCl2?2H2O,从而进行对废液的利用,其工艺流程如下:

部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀 | 2.3 | 7.5 | 4.7 |
| 完全沉淀 | 4.1 | 9.7 | 6.7 |
a.浓硫酸 b.Cl2 c.NaClO d.NaOH溶液.
考点:铁盐和亚铁盐的相互转变,铜金属及其重要化合物的主要性质,物质分离和提纯的方法和基本操作综合应用
专题:实验设计题,元素及其化合物
分析:(1)铜具有还原性,铁离子具有氧化性,二者之间发生氧化还原反应;
(2)金属铁可以和氯化铜反应置换出金属铜,剩余的铁可以和盐酸反应,但是金属铜和盐酸之间不反应;
(3)根据影响化学反应速率的因素结合图示的信息进行回答;
(4)将废液中的亚铁离子除去,加热蒸发,浓缩结晶即可得到纯净的氯化铜晶体,据此回答.
(2)金属铁可以和氯化铜反应置换出金属铜,剩余的铁可以和盐酸反应,但是金属铜和盐酸之间不反应;
(3)根据影响化学反应速率的因素结合图示的信息进行回答;
(4)将废液中的亚铁离子除去,加热蒸发,浓缩结晶即可得到纯净的氯化铜晶体,据此回答.
解答:
解:(1)铜具有还原性,铁离子具有氧化性,二者之间发生的氧化还原反应为:2FeCl3+Cu=2FeCl2+CuCl2,故答案为:2FeCl3+Cu=2FeCl2+CuCl2;
(2)①金属铁可以和氯化铜反应置换出金属铜,但是和氯化亚铁之间不反应,加入足量的金属铁,保证铜均被置换出来,剩余的铁可以和盐酸反应,但是金属铜和盐酸之间不反应,再过滤可以滤出金属铜,最后将铜干燥即可,故答案为:在滤渣中加入足量稀盐酸并搅拌;过滤;干燥;
②影响化学反应速率:粉末状物质的反应速率快于块状的,根据图象信息,a的反应速率最快,除铁效果最好,故答案为:a;使用细铁粉,还原得细铜粉,铜粉颗粒越小,与酸接触的表面积越大,内部的铁与酸反应越快,即除铁效率越高;
(3)为了将废液中的亚铁离子除去,加入一种试剂将亚铁离子氧化为铁离子,调节pH值,可以将铁离子沉淀出来,但是铜离子不沉淀即可,故选NaClO,它具有碱性和氧化性,能将Fe2+氧化为Fe3+,且反应能消耗H+,增大溶液的pH使Fe3+沉淀,故答案为:c;NaClO能将Fe2+氧化为Fe3+,且反应能消耗H+,增大溶液的pH使Fe3+沉淀.
(2)①金属铁可以和氯化铜反应置换出金属铜,但是和氯化亚铁之间不反应,加入足量的金属铁,保证铜均被置换出来,剩余的铁可以和盐酸反应,但是金属铜和盐酸之间不反应,再过滤可以滤出金属铜,最后将铜干燥即可,故答案为:在滤渣中加入足量稀盐酸并搅拌;过滤;干燥;
②影响化学反应速率:粉末状物质的反应速率快于块状的,根据图象信息,a的反应速率最快,除铁效果最好,故答案为:a;使用细铁粉,还原得细铜粉,铜粉颗粒越小,与酸接触的表面积越大,内部的铁与酸反应越快,即除铁效率越高;
(3)为了将废液中的亚铁离子除去,加入一种试剂将亚铁离子氧化为铁离子,调节pH值,可以将铁离子沉淀出来,但是铜离子不沉淀即可,故选NaClO,它具有碱性和氧化性,能将Fe2+氧化为Fe3+,且反应能消耗H+,增大溶液的pH使Fe3+沉淀,故答案为:c;NaClO能将Fe2+氧化为Fe3+,且反应能消耗H+,增大溶液的pH使Fe3+沉淀.
点评:本题以实验的方法考查学生含铁化合物的性质知识,注重物质的分离、提纯和化学实验基本操作的知识,难度中等.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
用酒精灯加热下列溶液,蒸干后灼烧,所得固体与溶质成份相同的是( )
| A、FeCl3溶液 |
| B、NaHCO3溶液 |
| C、Na2SO3溶液 |
| D、CH3COONa溶液 |
 X、Y、Z、R、W、M五种元素分别位于周期表中四个紧邻的周期,原子序数依次增大,其它相关信息如下列两表所示:
X、Y、Z、R、W、M五种元素分别位于周期表中四个紧邻的周期,原子序数依次增大,其它相关信息如下列两表所示: