题目内容
12.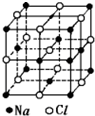 已知NaCl的摩尔质量为Mg.mol-1,NaCl晶体的密度为ρg.cm-3,图大正方体为NaCl晶体的最小重复单元(晶胞),其中顶点离子为8个晶胞所共有,晶胞中Na+与最邻近的Cl-的核间距离为a cm,则阿伏加德罗常数的值可表示为( )
已知NaCl的摩尔质量为Mg.mol-1,NaCl晶体的密度为ρg.cm-3,图大正方体为NaCl晶体的最小重复单元(晶胞),其中顶点离子为8个晶胞所共有,晶胞中Na+与最邻近的Cl-的核间距离为a cm,则阿伏加德罗常数的值可表示为( )| A. | 2Ma3ρ | B. | $\frac{M}{{a}^{3}ρ}$ | C. | $\frac{2M}{{a}^{3}ρ}$ | D. | $\frac{M}{2{a}^{3}ρ}$ |
分析 根据均摊法计算出一个晶胞中所包含的Na+与Cl-数目,利用晶体密度、晶胞体积和晶胞摩尔质量计算阿伏伽德罗常数.
解答 解:一个NaCl的晶胞中所包含的Na+为:12×$\frac{1}{4}$+1=4,Cl-数目为:8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,即1个NaCl晶胞的体积实际上是4个Na+和4个Cl-共同所占的体积,由NaCl晶胞示意图可知1个Na+与1个Cl-共同占有的体积为V=$\frac{1}{4}$×(2acm)3=2a3cm3,由等式NA•ρ•V=M,可得NA=$\frac{M}{2a{\;}^{3}ρ}$,
故选D.
点评 本题考查有关晶体计算等方法,应注意每个晶胞中所含微粒数目,然后计算摩尔质量,题目难度不等.

练习册系列答案
相关题目
3.有关下列微粒的化学用语正确的是( )
| A. | CS2的电子式为: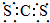 | |
| B. | Ca2+的离子结构示意图为: | |
| C. | HClO的结构式为:H-Cl-O | |
| D. | 质子数为35,中子数为46的核素的核素符号为:${\;}_{35}^{81}$Br |
20.有机化合物 的官能团是( )
的官能团是( )
 的官能团是( )
的官能团是( )| A. | 醛基 | B. | 羧基 | C. | 羟基 | D. | 醚键 |
7.NA代表阿伏加德罗常数.下列说法正确的是( )
| A. | 60g丙醇中存在的共价键总数为10NA | |
| B. | 0.1mol丙烯酸中含有双键的数目为0.1NA | |
| C. | 标准状况下,11.2L苯中含有分子的数目为0.5NA | |
| D. | 丙烯和环丙烷组成的42g混合气体中氢原子的个数为6 NA |
17.某研究性学习小组在实验室中配制1mol•L-1的稀硫酸标准溶液,然后用其滴定某未知浓度的NaOH溶液,下列有关说法错误的是:( )
| A. | 实验中所用到的滴定管、容量瓶,在使用前均需要检漏 | |
| B. | 如果实验中需用60 mL的稀硫酸标准溶液,配制时应选用100 mL容量瓶 | |
| C. | 酸式滴定管用蒸馏水洗涤后,即装入稀硫酸,则测得的NaOH溶液的浓度将偏大 | |
| D. | 滴定终点时,仰视滴定管的刻度,其他操作正确,测得的NaOH溶液的浓度将偏小 |
4.塑料抗氧化剂C可通过下列反应合成:

下列有关叙述正确的是( )

下列有关叙述正确的是( )
| A. | 物质A中所含碳原子可能在同一个平面内 | |
| B. | 物质A生成物质B是加成反应,物质B生成物质C是酯化反应 | |
| C. | 物质B具有酚羟基,但不能与浓溴水产生白色沉淀 | |
| D. | 1mol抗氧化剂C能与NaOH溶液反应,最多消耗3 molNaOH |
1.在铜与稀硝酸的反应中,如果有1mol的硝酸被还原,则被氧化的铜的物质的量为( )
| A. | 3 mol | B. | $\frac{3}{2}$mol | C. | $\frac{3}{8}$mol | D. | $\frac{8}{3}$mol |
2.下列实脸操作或由实验得出的结论,错误的是( )
| A. | 用蒸馏水湿润的试纸测某溶液的pH,一定会使结果偏低 | |
| B. | 可用酸式滴定管准确量取10.00mLKMnO4溶液 | |
| C. | 在中和热测定实验中,不能用温度计来搅拌溶液 | |
| D. | 将乙烯通入酸性高锰酸钾溶液,可检验乙烯的还原性 |