题目内容
15.0.3mol Cu2S与足量的浓HNO3反应,生成Cu(NO3)2、H2SO4、NO、H2O,则参加反应的硝酸中,未被还原的硝酸的量是( )| A. | 75.3g | B. | 2.2mol | C. | 1.2mol | D. | 1mol |
分析 Cu2S与足量的浓HNO3反应,生成Cu(NO3)2、H2SO4、NO、H2O,由Cu原子守恒可知Cu(NO3)2的物质的量,由N原子守恒可知未被还原的硝酸的量,以此来解答.
解答 解:由Cu2S与足量的浓HNO3反应,生成Cu(NO3)2、H2SO4、NO、H2O,可知生成NO时硝酸被还原,生成硝酸铜时未被还原,
由Cu原子守恒可知Cu(NO3)2的物质的量为0.3mol×2=0.6mol,
由N原子守恒可知未被还原的硝酸的量为0.6mol×2=1.2mol,
故选C.
点评 本题考查氧化还原反应的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,把握原子守恒及反应中的物质的量关系为解答该题的关键,题目难度不大.

练习册系列答案
相关题目
7.下列有关说法正确的是( )
| A. | 铜的金属活动性比铁弱,可以用铜罐代替铁罐盛装和运输浓硝酸 | |
| B. | 明矾净水与铁粉作食品的脱氧剂都利用了物质的还原性 | |
| C. | 钢瓶可以运输液氯 | |
| D. | 用氧化铝制成的耐高温坩埚可以用于熔融氢氧化钠 |
8.下列叙述正确的是( )
| A. | 1mol H2O的质量为18g/mol | |
| B. | 2g H2含有的氢原子数为6.02×1023 | |
| C. | 标准状况下,1mol SO3的体积为22.4L | |
| D. | 1L 1mol•L-1 NaOH溶液中含1mol Na+ |
3.有关下列微粒的化学用语正确的是( )
| A. | CS2的电子式为: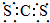 | |
| B. | Ca2+的离子结构示意图为: | |
| C. | HClO的结构式为:H-Cl-O | |
| D. | 质子数为35,中子数为46的核素的核素符号为:${\;}_{35}^{81}$Br |
10.下列递变情况中,正确的是( )
| A. | C、N、O的原子半径依次减小 | |
| B. | Si、P、S元素的最高正价依次降低 | |
| C. | Na、Mg、Al原子的最外层电子数依次减少 | |
| D. | Li、Na、K的金属性依次减弱 |
20.有机化合物 的官能团是( )
的官能团是( )
 的官能团是( )
的官能团是( )| A. | 醛基 | B. | 羧基 | C. | 羟基 | D. | 醚键 |
7.NA代表阿伏加德罗常数.下列说法正确的是( )
| A. | 60g丙醇中存在的共价键总数为10NA | |
| B. | 0.1mol丙烯酸中含有双键的数目为0.1NA | |
| C. | 标准状况下,11.2L苯中含有分子的数目为0.5NA | |
| D. | 丙烯和环丙烷组成的42g混合气体中氢原子的个数为6 NA |
4.塑料抗氧化剂C可通过下列反应合成:

下列有关叙述正确的是( )

下列有关叙述正确的是( )
| A. | 物质A中所含碳原子可能在同一个平面内 | |
| B. | 物质A生成物质B是加成反应,物质B生成物质C是酯化反应 | |
| C. | 物质B具有酚羟基,但不能与浓溴水产生白色沉淀 | |
| D. | 1mol抗氧化剂C能与NaOH溶液反应,最多消耗3 molNaOH |
 ;
;