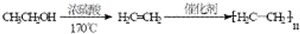题目内容
8.实验室用锌粒与2mol/L的硫酸制取氢气,下列措施不能增大该反应速率的是( )| A. | 加水稀释 | B. | 适当增大硫酸浓度 | ||
| C. | 加热 | D. | 用锌粉代替锌粒 |
分析 升高温度、增大浓度、构成原电池、增大接触面等,均可加快反应速率,以此来解答.
解答 解:A.加水稀释,氢离子浓度减小,反应速率减小,故A选;
B.适当增大硫酸浓度,氢离子浓度增大,反应速率加快,故B不选;
C.加热,反应速率加快,故C不选;
D.用锌粉代替锌粒,增大接触面积,反应速率加快,故D不选;
故选A.
点评 本题考查化学反应速率的影响因素,为高频考点,把握温度、浓度、接触面积等对反应速率的影响为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
18. 某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:
某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:
氢氧化钠少量时2NH4HSO4+2NaOH═(NH4)2SO4+Na2SO4+2H2O
氢氧化钠过量时NH4HSO4+2NaOH═Na2SO4+NH3↑+2H2O
(1)同学们设计的实验装置图如图,请回答相关问题.
①装置中碱石灰的作用是吸收氨气中的水蒸气.
②广口瓶内四氯化碳的作用是防止倒吸.
③指导老师指出,用该装置进行实验,即使氢氧化钠足量且实验过程中无氨气外逸,测得的样品含氮量仍将偏低,其原因可能是残留在反应装置中的氨气未被稀硫酸吸收.
(2)同学们改进实验装置后(改进装置图略),进行如下实验.
称取不同质量的上述样品分别与40.00mL相同浓度的氢氧化钠溶液混合,完全溶解后,加热充分反应(此温度下铵盐不分解),并使生成的氨气全部被稀硫酸吸收,测得氨气的质量.部分实验数据如表:
请计算(计算结果保留两位小数):
①样品中氮元素的质量分数是19.87%.
②所用氢氧化钠溶液的物质的量浓度为3.25 mol/L.
 某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:
某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:氢氧化钠少量时2NH4HSO4+2NaOH═(NH4)2SO4+Na2SO4+2H2O
氢氧化钠过量时NH4HSO4+2NaOH═Na2SO4+NH3↑+2H2O
(1)同学们设计的实验装置图如图,请回答相关问题.
①装置中碱石灰的作用是吸收氨气中的水蒸气.
②广口瓶内四氯化碳的作用是防止倒吸.
③指导老师指出,用该装置进行实验,即使氢氧化钠足量且实验过程中无氨气外逸,测得的样品含氮量仍将偏低,其原因可能是残留在反应装置中的氨气未被稀硫酸吸收.
(2)同学们改进实验装置后(改进装置图略),进行如下实验.
称取不同质量的上述样品分别与40.00mL相同浓度的氢氧化钠溶液混合,完全溶解后,加热充分反应(此温度下铵盐不分解),并使生成的氨气全部被稀硫酸吸收,测得氨气的质量.部分实验数据如表:
| 氢氧化钠溶液体积/mL | 40.00mL | ||
| 样品质量/g | 7.750 | 15.50 | 23.25 |
| 氨气质量/g | 1.870 | 1.870 | 1.700 |
①样品中氮元素的质量分数是19.87%.
②所用氢氧化钠溶液的物质的量浓度为3.25 mol/L.
19.用如图实验装置进行相应实验.装置正确且能达到实验目的是( )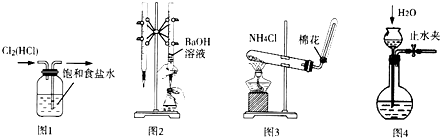

| A. | 用图l所示装置除去Cl2中的HCl杂质 | |
| B. | 用图2所示装置用标准浓度的氢氧化钠溶液测定盐酸的浓度 | |
| C. | 用图3所示装置实验室制取NH3 | |
| D. | 用图4所示装置检查装置气密性 |
3.下列物质中含有离子键的是( )
| A. | CO2 | B. | NaCl | C. | HCl | D. | CH4 |
13.2015年12月23日,北京的空气质量拉响警报,全市污染指数超过400,达到重度污染,严重影响人们的身体健康.关于空气污染,越来越需要引起我们的重视.下列说法正确的是( )
| A. | 二氧化硫、二氧化氮、一氧化碳和二氧化碳是空气质量报告中涉及的主要污染物 | |
| B. | 正常雨水的pH等于7 | |
| C. | 二氧化硫和二氧化氮是引起酸雨的主要气体 | |
| D. | 家用汽车有利于人们出行,需要大力推广应用 |
14.短周期主族元素X、Y、Z、W的原子序数依次增大.X、W在同一主族,Z+与Y3-具有相同的电子层结构,X原子的最外层电子数是其内层电子数的2倍.下列说法正确的是( )
| A. | 粒子半径的大小顺序:r(W)>r(X)>r(Z+)>r(Y3-) | |
| B. | X的最高价氧化物对应水化物的酸性比Y的强 | |
| C. | W的气态简单氢化物的热稳定性比X的强 | |
| D. | 工业上可用X的单质与W的氧化物反应制备W的单质 |
15.科学上规定,1.01×105Pa、25℃时,拆开1mol气态AB分子,使之变为1mol气态A原子和气态B原子,所需要吸收的能量,叫A-B键的“键能”.根据物质的结构与化学键的键能值,可以粗略判断化学反应过程的热效应,下面是一些常见化学键的键能值.
(1)根据上表的数据,计算由Cl2(g)和H2(g)化合生成1molHCl(g)时所释放的能量.
(2)判断甲烷的氯代反应Cl2(g)+CH4(g)═CH3Cl(g)+HCl(g),是吸热反应还是放热反应?
| 化学键 | H-Cl | Cl-Cl | H-H | C-H | C-Cl |
| 键能/(kJ•mol-1) | 431.4 | 242.1 | 435.9 | 413.0 | 338.9 |
(2)判断甲烷的氯代反应Cl2(g)+CH4(g)═CH3Cl(g)+HCl(g),是吸热反应还是放热反应?
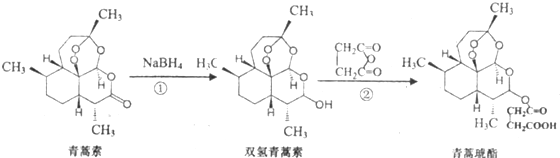
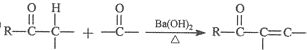
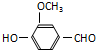 ,有关反应过程如下:
,有关反应过程如下: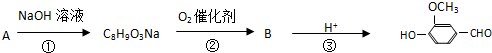
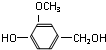 B
B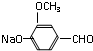 .
.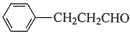 的合成路线流程图.(无机试剂任用,路线流程图示例如下:
的合成路线流程图.(无机试剂任用,路线流程图示例如下: