题目内容
(1)写出离子方程式2H++CO32-=H2O+CO2↑,相对应的化学反应方程式: .
(2)金属钠是银白色固体,质地很软,若将刚切割的钠露置在空气中一会儿,金属钠表面会变暗,原因是(用化学方程式表示) ;若将钠在空气中点燃,能生成一种 色固体,其反应的化学方程式是 ;金属钠能与水反应,请写出该反应的离子反应方程式 ,由此反应说明金属钠具有 性(填写氧化或还原).
(3)红热的铁能与水蒸气反应,有氢气生成.请写出铁与水蒸气反应的化学方程式 ,请用箭头(单线桥)标出其反应中电子转移的方向和总数,指出被氧化的元素是 (填写元素符号).当有1mol H2生成时有 mol的电子转移.
(4)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也激励着我们去奋发图强.黑火药爆炸时发生如下的反应:2KNO3+3C+S=K2S+N2↑+3CO2↑请指明该反应的,氧化剂 、 (填写化学式);标准状况下,当有4mol的电子转移时,产生CO2气体体积为 L.
(2)金属钠是银白色固体,质地很软,若将刚切割的钠露置在空气中一会儿,金属钠表面会变暗,原因是(用化学方程式表示)
(3)红热的铁能与水蒸气反应,有氢气生成.请写出铁与水蒸气反应的化学方程式
(4)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也激励着我们去奋发图强.黑火药爆炸时发生如下的反应:2KNO3+3C+S=K2S+N2↑+3CO2↑请指明该反应的,氧化剂
考点:离子方程式的书写,氧化还原反应,钠的化学性质,铁的化学性质
专题:元素及其化合物
分析:(1)强酸与可溶性碳酸盐反应生成可溶于盐和水、二氧化碳的离子反应为2H++CO32-=CO2↑+H2O.
(2)Na是非常活泼的金属,空气中易被氧气氧化,钠在空气中点燃生成淡黄色的过氧化钠,金属钠有还原性能与水反应;
(3)氧化还原反应中,得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂,还原剂被氧化,根据氢气和转移电子之间的关系式计算转移电子数;
(4)N、S元素的化合价降低,C元素的化合价升高,含元素化合价降低的物质为氧化剂,氧化剂被还原,而含元素化合价升高的物质为还原剂,根据二氧化碳和转移电子之间的关系式计算.
(2)Na是非常活泼的金属,空气中易被氧气氧化,钠在空气中点燃生成淡黄色的过氧化钠,金属钠有还原性能与水反应;
(3)氧化还原反应中,得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂,还原剂被氧化,根据氢气和转移电子之间的关系式计算转移电子数;
(4)N、S元素的化合价降低,C元素的化合价升高,含元素化合价降低的物质为氧化剂,氧化剂被还原,而含元素化合价升高的物质为还原剂,根据二氧化碳和转移电子之间的关系式计算.
解答:
解:(1)强酸与可溶性碳酸盐反应生成可溶于盐和水、二氧化碳的离子反应为2H++CO32-=CO2↑+H2O,
如2HCl+Na2CO3=2NaCl+CO2↑+H2O,
故答案为:2HCl+Na2CO3=2NaCl+CO2↑+H2O.
(2)Na是非常活泼的金属,空气中易被氧气氧化,反应方程为:4Na+O2=2Na2O,钠在空气中点燃生成淡黄色的过氧化钠,反应方程式为:2Na+O2
Na2O2,金属钠有还原性能与水反应,反应方程式为:2Na+H2O=2Na++2OH-+H2↑;
故答案为:4Na+O2=2Na2O、淡黄、2Na+O2
Na2O2、2Na+H2O=2Na++2OH-+H2↑;
(3)铁粉与水蒸气在高温下发生的反应中,化合价升高的元素是铁元素,Fe元素被氧化,失去电子,化合价降低元素是氢元素,得到电子,电子转移情况如下所示: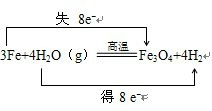 ,
,
设转移电子数是x,生成氢气的是1mol,
3Fe+4H2O(g)
Fe3O4+4H2 转移电子
4molL 8NA
1mol x
x=2
故答案为: 、Fe、2;
、Fe、2;
(4)在反应2KNO3+3C+S=K2S+N2↑+3CO2↑中,N元素的化合价由+5降低为0,
S元素的化合价由0降低为-2价,则KNO3和S作氧化剂,C元素的化合价由0升高到+4,
C~CO2~4电子
xmol 4mol
所以n(CO2)=1mol,V(CO2)=22.4L
故答案为:N、S;22.4L.
如2HCl+Na2CO3=2NaCl+CO2↑+H2O,
故答案为:2HCl+Na2CO3=2NaCl+CO2↑+H2O.
(2)Na是非常活泼的金属,空气中易被氧气氧化,反应方程为:4Na+O2=2Na2O,钠在空气中点燃生成淡黄色的过氧化钠,反应方程式为:2Na+O2
| ||
故答案为:4Na+O2=2Na2O、淡黄、2Na+O2
| ||
(3)铁粉与水蒸气在高温下发生的反应中,化合价升高的元素是铁元素,Fe元素被氧化,失去电子,化合价降低元素是氢元素,得到电子,电子转移情况如下所示:
 ,
,设转移电子数是x,生成氢气的是1mol,
3Fe+4H2O(g)
| ||
4molL 8NA
1mol x
x=2
故答案为:
 、Fe、2;
、Fe、2;(4)在反应2KNO3+3C+S=K2S+N2↑+3CO2↑中,N元素的化合价由+5降低为0,
S元素的化合价由0降低为-2价,则KNO3和S作氧化剂,C元素的化合价由0升高到+4,
C~CO2~4电子
xmol 4mol
所以n(CO2)=1mol,V(CO2)=22.4L
故答案为:N、S;22.4L.
点评:本题考查氧化还原反应,明确元素的化合价的变化及氧化还原反应中的基本概念是解答本题的关键,难度不大

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
甲酸乙酯和乙酸丁酯的混合物中,碳元素的质量分数为58.5%,则氢元素质量分数为( )
| A、41.5% |
| B、31.75% |
| C、20.5% |
| D、9.75% |
下列关于容量瓶使用的叙述中,正确的是( )
| A、使用前要检查容量瓶是否漏液 |
| B、用蒸馏水洗后必须要将容量瓶烘干 |
| C、为了操作简便,浓溶液稀释可直接在容量瓶中进行 |
| D、为了使所配溶液浓度均匀,定容结束后,手握瓶颈左右振荡 |



