题目内容
食盐是日常生活的必需品,也是重要的化工原料.
(1)粗食盐常含有少量K+、Ca2+、Fe3+、Mg2+、SO42-等杂质离子,实验室提纯NaCl的流程如下:

提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇、四氯化碳.
①欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为 BaCl2,NaOH,Na2CO3(只填化学式).
②洗涤除去NaCl晶体表面附带的少量KCl蒸发除去表面附带的KCl,选用的试剂为 .
(2)用提纯的NaCl配制500mL 0.20mol/L NaCl溶液,所用仪器除托盘天平、药匙、玻璃棒外还有 ,需称取NaCl: g.
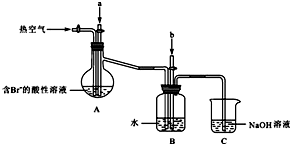
(3)实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4=ZnSO4+H2↑
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
从上述所给仪器装置中选择:
①制备并收集H2的装置为 (填代号).
②制备并收集干燥、纯净Cl2的装置为 (填代号).
(4)将实验制得的氯气不断通入硫化钠溶液中,取出少量反应液,向其中滴加氯化钡溶液有白色沉淀生成,试补足现象并解释之: .
(1)粗食盐常含有少量K+、Ca2+、Fe3+、Mg2+、SO42-等杂质离子,实验室提纯NaCl的流程如下:

提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇、四氯化碳.
①欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为
②洗涤除去NaCl晶体表面附带的少量KCl蒸发除去表面附带的KCl,选用的试剂为
(2)用提纯的NaCl配制500mL 0.20mol/L NaCl溶液,所用仪器除托盘天平、药匙、玻璃棒外还有
(3)实验室制备H2和Cl2通常采用下列反应:

Zn+H2SO4=ZnSO4+H2↑
MnO2+4HCl(浓)
| ||
从上述所给仪器装置中选择:
①制备并收集H2的装置为
②制备并收集干燥、纯净Cl2的装置为
(4)将实验制得的氯气不断通入硫化钠溶液中,取出少量反应液,向其中滴加氯化钡溶液有白色沉淀生成,试补足现象并解释之:
考点:物质分离和提纯的方法和基本操作综合应用,常见气体制备原理及装置选择
专题:实验题
分析:(1)①欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO42-离子,可以分别采用碳酸钠、氢氧化钠、氢氧化钠和氯化钡,根据除杂的原则来确定试剂的顺序来回答;
②根据有机物的性质以及氯化钾在有机物中的溶解度知识来回答;
(2)根据实验操作的步骤以及每步操作需要仪器确定反应所需仪器来解答;根据m=nM=CVM计算氯化钠的质量,根据天平的精确度确定称量的质量;
(3)实验室中采用金属锌和酸反应来获得氢气,利用二氧化锰和浓盐酸加热来获得氯气,氯气中氯化氢可以通过饱和食盐水来除去,水可以采用浓硫酸来除去;
(4)根据氯气通入硫化钠溶液中,氯气能置换出硫,继续通入氯气,氯气能氧化硫生成硫酸根离子和氯离子来分析.
②根据有机物的性质以及氯化钾在有机物中的溶解度知识来回答;
(2)根据实验操作的步骤以及每步操作需要仪器确定反应所需仪器来解答;根据m=nM=CVM计算氯化钠的质量,根据天平的精确度确定称量的质量;
(3)实验室中采用金属锌和酸反应来获得氢气,利用二氧化锰和浓盐酸加热来获得氯气,氯气中氯化氢可以通过饱和食盐水来除去,水可以采用浓硫酸来除去;
(4)根据氯气通入硫化钠溶液中,氯气能置换出硫,继续通入氯气,氯气能氧化硫生成硫酸根离子和氯离子来分析.
解答:
解:(1)①要除去SO42-,只有选BaCl2溶液,若选用Ba(NO3)2,会引入新的离子NO3-,再选用NaOH溶液除去Mg2+和Fe3+溶液,最后选用Na2CO3溶液除去Ca2+,此处不能选用K2CO3溶液,否则会引入新的K+,再用HCl除去过量的CO32-,Na2CO3溶液不能加在BaCl2溶液前,否则会引入Ba2+;
故答案为:BaCl2、NaOH、Na2CO3;
②除去NaCl晶体表面的少量的KCl,应选用75%的乙醇,因为CCl4有毒,同时KCl也不会溶解在CCl4中,
故答案为:75%乙醇;
(2)配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,冷却后转移到500mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管,所用仪器除托盘天平、药匙、玻璃棒外还有烧杯、500mL容量瓶、胶头滴管,
NaCl的质量m=nM=CVM=0.2mol/L×0.5L×58.5g/mol=5.85g,但天平的精确度为0.1g,需称取NaCl的质量为5.9g,
故答案为:烧杯、500mL容量瓶、胶头滴管;5.9;
(3)实验室中采用金属锌和酸不加热反应来获得氢气,故选择装置e,利用二氧化锰和浓盐酸加热来获得氯气,氯气中氯化氢可以通过饱和食盐水来除去,水可以采用浓硫酸来除去,可以选择装置d,
故答案为:e;d;
(4)氯气通入硫化钠溶液中,氯气能置换出硫,继续通入氯气,氯气能氧化硫生成硫酸根离子和氯离子,取出少量反应液,向其中滴加氯化钡溶液有硫酸钡白色沉淀生成,所以现象为先产生淡黄色沉淀,然后沉淀消失;
故答案为:先产生淡黄色沉淀,然后沉淀消失;原因是氯气不断通入硫化钠溶液中,氯气能置换出硫,继续通入氯气,氯气能氧化硫生成硫酸根离子和氯离子.
故答案为:BaCl2、NaOH、Na2CO3;
②除去NaCl晶体表面的少量的KCl,应选用75%的乙醇,因为CCl4有毒,同时KCl也不会溶解在CCl4中,
故答案为:75%乙醇;
(2)配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,冷却后转移到500mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管,所用仪器除托盘天平、药匙、玻璃棒外还有烧杯、500mL容量瓶、胶头滴管,
NaCl的质量m=nM=CVM=0.2mol/L×0.5L×58.5g/mol=5.85g,但天平的精确度为0.1g,需称取NaCl的质量为5.9g,
故答案为:烧杯、500mL容量瓶、胶头滴管;5.9;
(3)实验室中采用金属锌和酸不加热反应来获得氢气,故选择装置e,利用二氧化锰和浓盐酸加热来获得氯气,氯气中氯化氢可以通过饱和食盐水来除去,水可以采用浓硫酸来除去,可以选择装置d,
故答案为:e;d;
(4)氯气通入硫化钠溶液中,氯气能置换出硫,继续通入氯气,氯气能氧化硫生成硫酸根离子和氯离子,取出少量反应液,向其中滴加氯化钡溶液有硫酸钡白色沉淀生成,所以现象为先产生淡黄色沉淀,然后沉淀消失;
故答案为:先产生淡黄色沉淀,然后沉淀消失;原因是氯气不断通入硫化钠溶液中,氯气能置换出硫,继续通入氯气,氯气能氧化硫生成硫酸根离子和氯离子.
点评:本题主要考查了在粗盐提纯的过程中所选用除杂和净化的方法,除去杂质不要引入新的杂质,对于实验过程中过量的试剂都要除去.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
同温同压下,在两个密闭容器中分别充有等质量的甲、乙两种气体,且甲的密度大于乙的密度.则下列说法正确的是( )
| A、甲的摩尔体积比乙摩尔体积小 |
| B、甲的分子数比乙的分子数多 |
| C、甲的物质的量比乙的物质的量少 |
| D、甲的相对分子质量比乙相对分子质量小 |
下列化学反应中,属于氧化还原反应的是( )
| A、NaOH+HCl=NaCl+H2O | ||||
B、2NaHCO3
| ||||
| C、Fe+CuSO4=Cu+FeSO4 | ||||
| D、NH3+HCl=NH4Cl |
下列离子方程式中,正确的是( )
| A、石灰石与盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O |
| B、氧化铁和稀硫酸反应:Fe2O3+6H+=2Fe2++3H2O |
| C、氢氧化铜溶于盐酸:Cu2++2OH-+2H+=Cu2++2H2O |
| D、MgCl2溶液中滴加氨水:Mg2++2OH-=Mg(OH)2↓ |
 新型纳米材料MFe2Ox(3<x<4)中M表示+2价的金属元素,在反应中化合价不发生变化.常温下,MFe2Ox能使工业废气中的SO2转化为S,转化过程表示如图所示,则下列判断正确的是( )
新型纳米材料MFe2Ox(3<x<4)中M表示+2价的金属元素,在反应中化合价不发生变化.常温下,MFe2Ox能使工业废气中的SO2转化为S,转化过程表示如图所示,则下列判断正确的是( )| A、MFe2Ox是还原剂 |
| B、SO2是该反应的催化剂 |
| C、x>y |
| D、氧化性:MFe2Oy>SO2 |
 请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式
请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式