题目内容
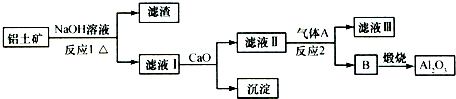
铝土矿的主要成分是Al2O3、Fe2O3、SiO2等,从铝土矿冶炼Al2O3的流程如下:
下列说法正确的是( )

下列说法正确的是( )
| A、气体A一定为HCl |
| B、滤液Ⅰ中溶质仅含NaAlO2 |
| C、沉淀的主要成分为硅酸钙 |
| D、反应1、反应2均不是氧化还原反应 |
考点:物质的分离、提纯和除杂,镁、铝的重要化合物
专题:几种重要的金属及其化合物
分析:SiO2和盐酸不反应,Fe2O3和氢氧化钠不反应而氧化铝能反应,向偏铝酸钠中通入过量的二氧化碳可以生成氢氧化铝沉淀.
铝土矿中加入氢氧化钠溶液,氧化铝和二氧化硅与氢氧化钠反应生成偏铝酸钠和硅酸钠,则滤液Ⅰ为NaAlO2和硅酸钠,加入氢氧化钙,生成硅酸钙沉淀,滤液Ⅱ为偏铝酸钠,可通入二氧化碳气体,生成B为氢氧化铝,煅烧可生成氧化铝,以此解答该题.
铝土矿中加入氢氧化钠溶液,氧化铝和二氧化硅与氢氧化钠反应生成偏铝酸钠和硅酸钠,则滤液Ⅰ为NaAlO2和硅酸钠,加入氢氧化钙,生成硅酸钙沉淀,滤液Ⅱ为偏铝酸钠,可通入二氧化碳气体,生成B为氢氧化铝,煅烧可生成氧化铝,以此解答该题.
解答:
解:铝土矿中加入氢氧化钠溶液,氧化铝和二氧化硅与氢氧化钠反应生成偏铝酸钠和硅酸钠,则滤液Ⅰ为NaAlO2和硅酸钠,加入氢氧化钙,生成硅酸钙沉淀,滤液Ⅱ为偏铝酸钠,可通入二氧化碳气体,生成B为氢氧化铝,煅烧可生成氧化铝,
A.气体A应为二氧化碳,故A错误;
B.滤液Ⅰ为NaAlO2和硅酸钠,故B错误;
C.由以上分析可知沉淀为硅酸钙,故C正确;
D.反应1、反应2均均为复分解反应,以上化合价没有发生变化,不是氧化还原反应,故D正确.
故选CD.
A.气体A应为二氧化碳,故A错误;
B.滤液Ⅰ为NaAlO2和硅酸钠,故B错误;
C.由以上分析可知沉淀为硅酸钙,故C正确;
D.反应1、反应2均均为复分解反应,以上化合价没有发生变化,不是氧化还原反应,故D正确.
故选CD.
点评:本题考查二氧化硅和铝及其化合物的性质,为高频考点,侧重与学生的分析能力和实验能力的考查,把握流程中发生的化学反应为解答的关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列关于电解质溶液的叙述正确的是( )
| A、常温下,由0.1mol/L一元碱BOH溶液的pH=10,可推知BOH溶液存在:BOH?B++OH- |
| B、常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)>c(NH4+)>c(H+)=c(OH-) |
| C、中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 |
| D、将pH=4的盐酸稀释后,溶液中所有离子的浓度均降低 |
 含一个碳碳三键的炔烃加氢后的结构简式为该炔烃可能的结构有( )
含一个碳碳三键的炔烃加氢后的结构简式为该炔烃可能的结构有( )| A、2种 | B、3种 | C、4种 | D、5种 |
往下列溶液中滴加FeCl3溶液,无变化的是( )
A、 |
B、 |
C、 |
| D、氢碘酸 |
下列有关实验中叙述不正确的是( )
| A、向2mL 5% H2O2溶液中滴入0.1 mol/L FeCl3溶液1 mL,能较快的产生气体 |
| B、向KMnO4酸性溶液中加入过量草酸溶液,溶液紫红色褪去 |
| C、向酸性K2Cr2O7溶液中加入适量的NaOH溶液,溶液由黄色变为橙色 |
| D、向5mL 0.1mol/L Na2S2O3溶液中加入稀H2SO4,一段时间后溶液变浑浊 |
下列说法正确的是( )
| A、KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质 |
| B、100℃时,pH=2的盐酸和pH=12的NaOH溶液等体积混合后,溶液为碱性 |
| C、pH=a的醋酸溶液加水稀释十倍后,溶液pH=a+1 |
| D、25℃时,用浓度均为0.1000mol/L的醋酸和盐酸溶液滴定等浓度NaOH溶液,二者pH突变范围相同 |
下列有关化学用语正确的是( )
A、Na+的基态电子排布图是: |
| B、质量数之和比质子数之和大的水分子符号可能是:D218O |
C、Na2S的电子式: |
D、氯离子结构示意图为: |
 如图装置可用于收集某气体并验证其某些化学性质,你认为如表正确的是( )
如图装置可用于收集某气体并验证其某些化学性质,你认为如表正确的是( )