题目内容
下列有关实验中叙述不正确的是( )
| A、向2mL 5% H2O2溶液中滴入0.1 mol/L FeCl3溶液1 mL,能较快的产生气体 |
| B、向KMnO4酸性溶液中加入过量草酸溶液,溶液紫红色褪去 |
| C、向酸性K2Cr2O7溶液中加入适量的NaOH溶液,溶液由黄色变为橙色 |
| D、向5mL 0.1mol/L Na2S2O3溶液中加入稀H2SO4,一段时间后溶液变浑浊 |
考点:含硫物质的性质及综合应用,化学平衡的影响因素,浓度、温度、催化剂对化学反应速率的影响
专题:化学平衡专题,氧族元素
分析:A.0.1 mol/L FeCl3溶液能降低反应所需的活化能;
B.KMnO4溶液具有强氧化性,草酸具有较强的还原性,发生氧化还原反应溶液紫红色褪去;
C.酸性K2Cr2O7溶液为橙色,强氧化性的K2Cr2O7溶液中,存在如下平衡:Cr2O72-(橙色)+H2O?2CrO42- (黄色)+2H+,根据平衡移动原理解答;
D.硫代硫酸钠(Na2S2O3)硫元素化合价为+2价,在稀硫酸溶液中能够发生自身氧化还原反应,生成二氧化硫气体和单质硫;
B.KMnO4溶液具有强氧化性,草酸具有较强的还原性,发生氧化还原反应溶液紫红色褪去;
C.酸性K2Cr2O7溶液为橙色,强氧化性的K2Cr2O7溶液中,存在如下平衡:Cr2O72-(橙色)+H2O?2CrO42- (黄色)+2H+,根据平衡移动原理解答;
D.硫代硫酸钠(Na2S2O3)硫元素化合价为+2价,在稀硫酸溶液中能够发生自身氧化还原反应,生成二氧化硫气体和单质硫;
解答:
解:A.催化剂能降低反应所需的活化能,从而加快反应速率,FeCl3溶液中的Fe3+催化分解H2O2,能较快的产生氧气,故A正确;
B.KMnO4溶液具有强氧化性,氧化草酸发生反应:2KMnO4+5 H2C2O4+3H2SO4═K2SO4+10CO2↑+2 MnSO4+8H2O,溶液紫红色褪去,故B正确;
C.强氧化性的K2Cr2O7溶液中,存在如下平衡:Cr2O72-(橙色)+H2O?2CrO42- (黄色)+2H+,加入适量烧碱固体,烧碱和氢离子反应使平衡向正反应方向移动,橙色变浅,故C错误;
D.硫代硫酸钠(Na2S2O3)与稀硫酸溶液作用时发生如下反应:Na2S2O3+H2SO4═Na2SO4+SO2↑+S↓+H2O,溶液变浑浊,故D正确;
故选C.
B.KMnO4溶液具有强氧化性,氧化草酸发生反应:2KMnO4+5 H2C2O4+3H2SO4═K2SO4+10CO2↑+2 MnSO4+8H2O,溶液紫红色褪去,故B正确;
C.强氧化性的K2Cr2O7溶液中,存在如下平衡:Cr2O72-(橙色)+H2O?2CrO42- (黄色)+2H+,加入适量烧碱固体,烧碱和氢离子反应使平衡向正反应方向移动,橙色变浅,故C错误;
D.硫代硫酸钠(Na2S2O3)与稀硫酸溶液作用时发生如下反应:Na2S2O3+H2SO4═Na2SO4+SO2↑+S↓+H2O,溶液变浑浊,故D正确;
故选C.
点评:本题利用实验设计方案或实验事实考查同学们的判断能力,抓住题目信息,根据物质的性质和物质间的反应规律进行分析判断是解题的关键,题目难度中等.

练习册系列答案
相关题目
利用下列实验装置进行的相应实验,不能达到实验目的是( )


| A、图1所示装置可制取乙炔 |
| B、图2所示装置可分离乙酸乙酯和醋酸钠的水溶液 |
| C、图3所示装置可制取乙烯并验证其易被氧化 |
| D、图4所示装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性 |
一定质量的甲烷燃烧后得到的产物为CO、CO2和水蒸气,此混合气体质量为49.6g,当其缓慢经过无水CaCl2时,CaCl2增重25.2g.甲烷的质量为( )
| A、12.5g |
| B、13.2g |
| C、11.2g |
| D、24.4g |
下列关于“化学之最”,说法正确的是( )
①铝是地壳里含量最多的金属元素;
②第六周期是目前周期表中含元素最多的周期;
③Na是短周期元素中原子半径最大的主族元素.
①铝是地壳里含量最多的金属元素;
②第六周期是目前周期表中含元素最多的周期;
③Na是短周期元素中原子半径最大的主族元素.
| A、全对 | B、除①外全对 |
| C、除②外全对 | D、除③外全对 |
铝土矿的主要成分是Al2O3、Fe2O3、SiO2等,从铝土矿冶炼Al2O3的流程如下:
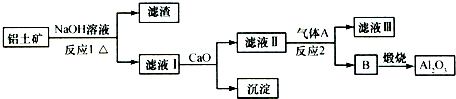
下列说法正确的是( )

下列说法正确的是( )
| A、气体A一定为HCl |
| B、滤液Ⅰ中溶质仅含NaAlO2 |
| C、沉淀的主要成分为硅酸钙 |
| D、反应1、反应2均不是氧化还原反应 |
下列说法正确的是( )
| A、0.5molH2所占的体积为11.2L |
| B、标准状况下,6.02×1023个分子所占的体积约是22.4L |
| C、阿伏伽德罗常数就是6.02×1023,没有单位 |
| D、H2的摩尔质量为2g/mol |
工业上合成氨的方程式为 N2+3H2
2NH3,有关该反应的说法不正确的是( )
| 高温高压 |
| 催化剂 |
| A、该反应为可逆反应,故在一定条件下氮气和氢气不可能全部转化为氨气 |
| B、达到平衡后,反应就停止了,故此时正、逆反应速率相等且均为零 |
| C、一定条件下,向某密闭容器中加入1mol N2和3mol H2,则从反应开始到达到平衡的过程中,正反应速率不断减小,逆反应速率不断增大,某一时刻,正、逆反应速率相等 |
| D、在利用上述反应生产氨气时,要同时考虑反应所能达到的限度和化学反应速率两方面的问题 |
某浓度的氨水中存在下列平衡:NH3?H2O?NH4++OH-,如想增大NH4+的浓度,而不增大OH-的浓度,应采取的措施是( )
| A、适当升高温度 |
| B、加入NaOH固体 |
| C、通入NH3 |
| D、加入NH4Cl固体 |
设NA为阿伏加德罗常数,下列叙述中正确的是( )
| A、1Llmol/L醋酸溶液中离子总数为2NA |
| B、标准状况下,2.24L的己烷中含有C-H键的数目为0.6NA |
| C、常温常压下,1mol苯含C=C为3NA |
| D、乙烯和丙烯的混合物1.4g中含有0.1NA个碳原子 |