题目内容
下列溶液中离子的检验方法和结论相符的一组是( )
| 序号 | 检验方法 | 结论 |
| A | 向未知溶液中加入硝酸酸化的BaCl2溶液,有白色沉淀生成 | 未知溶液中一定含有SO42- |
| B | 向种未知溶液中滴加NaOH溶液,产生白色沉淀 | 未知溶液中一定含有Al3+ |
| C | 向未知溶液中加入盐酸,产生能使澄清石灰水变浑浊的无色无味的气体 | 不能确定未知溶液中一定含有CO32- |
| D | 向未知溶液中加入稀盐酸酸化后,再加入AgNO3溶液,有白色沉淀生成 | 未知溶液中一定含有Cl- |
| A、A | B、B | C、C | D、D |
考点:物质的检验和鉴别的实验方案设计,常见阳离子的检验,常见阴离子的检验
专题:实验设计题,实验评价题
分析:A.白色沉淀可能为AgCl,且硝酸酸化可能将亚硫酸根离子氧化为硫酸根离子;
B.白色沉淀可能为氢氧化镁等;
C.使澄清石灰水变浑浊的无色无味的气体,为二氧化碳;
D.加入稀盐酸酸化,引入Cl-,干扰其检验.
B.白色沉淀可能为氢氧化镁等;
C.使澄清石灰水变浑浊的无色无味的气体,为二氧化碳;
D.加入稀盐酸酸化,引入Cl-,干扰其检验.
解答:
解:A.白色沉淀可能为AgCl,且硝酸酸化可能将亚硫酸根离子氧化为硫酸根离子,应先加盐酸,再加BaCl2溶液检验SO42-,故A错误;
B.白色沉淀可能为氢氧化镁等,则未知溶液中不一定含有Al3+,若白色沉淀加碱又溶解,则未知溶液中一定含有Al3+,故B错误;
C.使澄清石灰水变浑浊的无色无味的气体,为二氧化碳,原溶液中可能含CO32-或HCO3-,不能确定未知溶液中一定含有CO32-,故C正确;
D.加入稀盐酸酸化,引入Cl-,干扰其检验,应加硝酸酸化,故D错误;
故选C.
B.白色沉淀可能为氢氧化镁等,则未知溶液中不一定含有Al3+,若白色沉淀加碱又溶解,则未知溶液中一定含有Al3+,故B错误;
C.使澄清石灰水变浑浊的无色无味的气体,为二氧化碳,原溶液中可能含CO32-或HCO3-,不能确定未知溶液中一定含有CO32-,故C正确;
D.加入稀盐酸酸化,引入Cl-,干扰其检验,应加硝酸酸化,故D错误;
故选C.
点评:本题考查物质的检验和鉴别实验方案的设计,为高频考点,把握离子的检验方法、试剂及现象与结论为解答的关键,侧重离子检验的考查,注意检验应排除干扰离子,题目难度不大.

练习册系列答案
相关题目
下列关于烷烃性质的叙述中,不正确的是( )
| A、烷烃同系物随相对分子质量增大,熔点、沸点逐渐升高;常温下的状态由气态递变到液态,相对分子质量大的则为固态 |
| B、烷烃同系物的密度随相对分子质量增大逐渐增大 |
| C、烷烃跟卤素单质在光照条件下能发生取代反应 |
| D、烷烃同系物都能使溴水、酸性KMnO4溶液褪色 |
按电子排布,可把周期表里的元素划分成5个区,以下元素属于P区的是( )
| A、Fe | B、Mg | C、Te | D、Ni |
下列各组中每种物质都既有离子键又有共价键的一组是( )
| A、NaOH H2SO4 (NH4)2SO4 |
| B、Na2O2 KOH Na3PO4 |
| C、MgO Na2SO4 HNO3 |
| D、HCl Al2O3 MgCl2 |
铝土矿的主要成分是Al2O3、Fe2O3、SiO2等,从铝土矿冶炼Al2O3的流程如下:
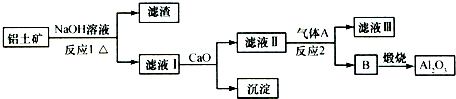
下列说法正确的是( )

下列说法正确的是( )
| A、气体A一定为HCl |
| B、滤液Ⅰ中溶质仅含NaAlO2 |
| C、沉淀的主要成分为硅酸钙 |
| D、反应1、反应2均不是氧化还原反应 |
在3Cl2+6KOH
KClO3+5KCl+3H2O的反应中,下列说法不正确的是( )
| ||
| A、Cl2是氧化剂,KOH是还原剂 |
| B、KCl是还原产物,KClO3是氧化产物 |
| C、反应中每消耗3mol Cl2,转移电子数为5NA |
| D、被还原的氯气的物质的量是被氧化的氯气的物质的量的5倍 |
下列基态原子的价电子构型中,正确的是( )
| A、3d94s2 |
| B、3d44s2 |
| C、3d54s24p3 |
| D、4d25s2 |
下列有机物中属于烃的是( )
| A、乙醇 | B、乙酸 | C、甲苯 | D、乙醛 |