题目内容
 如图装置可用于收集某气体并验证其某些化学性质,你认为如表正确的是( )
如图装置可用于收集某气体并验证其某些化学性质,你认为如表正确的是( )| 选项 | 气体 | 试剂 | 现象 | 结论 |
| A | Cl2 | 紫色石蕊试液 | 溶液先变红后褪色 | 氯水有酸性和漂白性 |
| B | NH3 | 水 | 无明显现象 | NH3能溶于水 |
| C | X | 澄清石灰水 | 溶液变浑浊 | 气体可能是CO2 |
| D | SO2 | 酸性KMnO4(aq) | 溶液褪色 | SO2有漂白性 |
| A、A | B、B | C、C | D、D |
考点:实验装置综合,性质实验方案的设计
专题:实验设计题
分析:由图可知,为向上排空气法收集,则气体的密度比空气的大,然后结合气体的性质及发生的反应来解答.
解答:
解:A.氯气的密度比空气大,收集方法合理,氯气与水反应生成HCl、HClO分别具有酸性、漂白性,则紫色石蕊先变红后褪色,故A正确;
B.氨气的密度比空气小,应利用向下排空气法收集,故B错误;
C.二氧化碳与石灰水反应生成沉淀,且密度比空气大,则澄清石灰水变浑浊,气体可能是CO2,故C正确;
D.二氧化硫的密度比空气大,收集方法合理,但与高锰酸钾发生氧化还原反应,体现二氧化硫的还原性,与漂白性无关,故D错误;
故选AC.
B.氨气的密度比空气小,应利用向下排空气法收集,故B错误;
C.二氧化碳与石灰水反应生成沉淀,且密度比空气大,则澄清石灰水变浑浊,气体可能是CO2,故C正确;
D.二氧化硫的密度比空气大,收集方法合理,但与高锰酸钾发生氧化还原反应,体现二氧化硫的还原性,与漂白性无关,故D错误;
故选AC.
点评:本题考查实验装置综合,为高频考点,把握气体的密度及发生的反应为解答的关键,注意现象与结论的关系,侧重物质性质及实验能力的考查,题目难度不大.

练习册系列答案
相关题目
燃气灶中心的金属容易生锈,这说明化学腐蚀速率与( )有关.
| A、催化剂 | B、温度 |
| C、反应物本性 | D、气体浓度 |
铝土矿的主要成分是Al2O3、Fe2O3、SiO2等,从铝土矿冶炼Al2O3的流程如下:
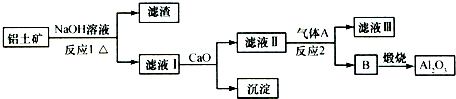
下列说法正确的是( )

下列说法正确的是( )
| A、气体A一定为HCl |
| B、滤液Ⅰ中溶质仅含NaAlO2 |
| C、沉淀的主要成分为硅酸钙 |
| D、反应1、反应2均不是氧化还原反应 |
工业上合成氨的方程式为 N2+3H2
2NH3,有关该反应的说法不正确的是( )
| 高温高压 |
| 催化剂 |
| A、该反应为可逆反应,故在一定条件下氮气和氢气不可能全部转化为氨气 |
| B、达到平衡后,反应就停止了,故此时正、逆反应速率相等且均为零 |
| C、一定条件下,向某密闭容器中加入1mol N2和3mol H2,则从反应开始到达到平衡的过程中,正反应速率不断减小,逆反应速率不断增大,某一时刻,正、逆反应速率相等 |
| D、在利用上述反应生产氨气时,要同时考虑反应所能达到的限度和化学反应速率两方面的问题 |
下列基态原子的价电子构型中,正确的是( )
| A、3d94s2 |
| B、3d44s2 |
| C、3d54s24p3 |
| D、4d25s2 |
某浓度的氨水中存在下列平衡:NH3?H2O?NH4++OH-,如想增大NH4+的浓度,而不增大OH-的浓度,应采取的措施是( )
| A、适当升高温度 |
| B、加入NaOH固体 |
| C、通入NH3 |
| D、加入NH4Cl固体 |
 实验室利用下列装置(夹持仪器略)测定水中氢、氧元素的质量比,测得反应前后硬质玻璃管的质量分别为a、b,球形干燥管的质量分别为c、d下列叙述错误的是( )
实验室利用下列装置(夹持仪器略)测定水中氢、氧元素的质量比,测得反应前后硬质玻璃管的质量分别为a、b,球形干燥管的质量分别为c、d下列叙述错误的是( )| A、实验结果表示式为:m(H):m(O)=(d-c-a+b):(a-b) | ||
| B、实验结果m(H):m(O)>1:8,即测定结果偏大 | ||
| C、实验开始时必须先通入H2,完全排除装置中的空气,然后加热 | ||
D、实验结果表示式为:m(H):m(O)=
|
下列关于FeCl3溶液和Fe(OH)3胶体的说法中正确的是( )
| A、都呈红褐色 |
| B、向Fe(OH)3胶体中滴加几滴浓盐酸,可能看到有沉淀产生 |
| C、利用滤纸过滤的方法可以分离两者 |
| D、微粒大小都在1~100nm之间 |
除去苯中的少量苯酚杂质的通常方法是( )
| A、加水振荡,静置分层后用分液漏斗分离 |
| B、加NaOH溶液振荡后,静置分液 |
| C、加溴水振荡后,过滤 |
| D、加CCl4振荡后,静置分液 |