题目内容
2.下列有关电池的说法正确的是( )| A. | 手机上用的锂离子电池属于二次电池 | |
| B. | 铜锌原电池工作时,电子从铜电极流向锌电极 | |
| C. | 氢氧燃料电池可把化学能转化为电能 | |
| D. | 锌锰干电池中,锌电极是负极 |
分析 A.锂离子电池属于二次电池;
B.铜锌原电池放电时,电子从负极沿导线流向正极;
C.氢氧燃料电池属于原电池;
D.锌锰干电池中,锌易失电子而作负极.
解答 解:A.锂离子电池中能循环使用,属于二次电池,故A正确;
B.铜锌原电池中,锌易失电子而作负极,铜作正极,电子从负极沿导线流向正极,故B错误;
C.燃料电池属于原电池,是将化学能转变为电能的装置,故C正确;
D.锌锰干电池中,锌易失电子发生氧化反应而作负极,故D正确;
故选ACD.
点评 本题考查了原电池原理,明确原电池正负极的判断方法、电子的流向即可解答,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.下列变化只有物理变化的是( )
| A. | 荒野中出现的忽明忽暗的“天火” | |
| B. | 在低温、加压的条件下无色的气态氧变成淡蓝色的液体 | |
| C. | 固态物质在加热的条件下融化成为液体,在更高的温度下转变为气体 | |
| D. | 把棉布染上颜色 |
10.短周期元素X、Y、Z、W的原子序数依次增大,它们的原子最外层电子数为互不相等的奇数,且X、Y、W原子最外层电子数之和恰好等于Z元素的核电荷数,X与W的最高化合价之和为8,常见金属元素Z的一种核素的质量数为28,中子数比质子数多2.下列说法中正确的是( )
| A. | Y和W的含氧酸均为强酸 | |
| B. | YW3分子中Y原子的杂化方式为sp2,分子的空间构型为平面三角形 | |
| C. | 由非金属元素组成的化合物YX5是一种是否存在尚待确证的化合物,假如存在,该物质与水反应必然生成气体X2,同时得到一种弱碱溶液 | |
| D. | 因为Z的氧化物熔点很高,不适宜于电解,故工业上常用电解Z与W的化合物的方法制取单质Z |
7.部分弱酸的电离平衡常数如表:
在25℃时,下列选项不正确的是( )
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离常数(25℃) | Ka=1.77×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
| A. | 反应CN-+H2O+CO2═HCN+HCO3-能够发生 | |
| B. | 中和等体积、等pH的HCOOH和HCN消耗NaOH的量,前者小于后者 | |
| C. | 物质的量浓度相等的HCOONa和KCN溶液中,c(Na+)-{c(HCOO-)}<c(K+)-c(CN-) | |
| D. | c(NH4+)相等的HCOONH4溶液、NH4CN溶液、NH4HCO3溶液中,c(NH4HCO3)>c(NH4CN)>c(HCOONH4) |
14.下列有关pH变化的判断中,正确的是( )
| A. | 随着温度的升高,碳酸溶液的pH减小 | |
| B. | 随着温度的升高,纯水的pH减小 | |
| C. | 新氯水制经光照一段时间后,pH减小 | |
| D. | 氢氧化钠溶液久置于空气中,pH增大 |
12.下列反应既属于氧化还原反应,又是吸热反应的是( )
| A. | 锌粒与稀硫酸的反应 | |
| B. | 甲烷在空气中燃烧的反应 | |
| C. | 灼热的木炭与CO2的反应 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 |

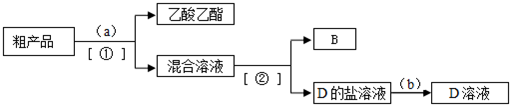
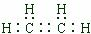 ;B中含官能团名称是羟基.
;B中含官能团名称是羟基.