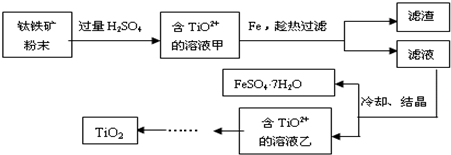
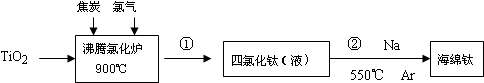
题目内容
4.下列离子方程式正确的是( )| A. | 过量氨水与氯化铝溶液反应:Al3++3OH-═Al(OH)3↓ | |
| B. | 氢氧化铝溶于稀盐酸中:H++OH-═H2O | |
| C. | 氢氧化铝溶于氢氧化钠溶液:Al(OH)3+OH-═AlO2-+2H2O | |
| D. | 过量氢氧化钠溶液与氯化铝溶液反应:Al3++3OH-═Al(OH)3↓ |
分析 A.一水合氨为弱电解质,保留化学式;
B.氢氧化铝为沉淀,保留化学式;
C.二者反应生成偏铝酸钠和水;
D.不符合反应客观事实.
解答 解:A.过量氨水与氯化铝溶液反应,离子方程式:Al3++3NH3•H2O→Al(OH)3↓+3NH4+,故A错误;
B.氢氧化铝溶于稀盐酸中,离子方程式:3H++Al(OH)3═3H2O+Al3+,故B错误;
C.氢氧化铝溶于氢氧化钠溶液,离子方程式:Al(OH)3+OH-═AlO2-+2H2O,故C正确;
D.过量的氢氧化钠溶液与氯化铝溶液反应的离子反应为Al3++4OH-=2H2O+AlO2-,故D错误;
故选:C.
点评 本题考查离子反应方程式的书写,把握发生的反应及离子反应的书写方法为解答的关键,注意化学式的拆分,题目难度不大.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案
相关题目
14.下列实验方法能达到实验目的是( )
| A. | 用淀粉溶液检验溶液中是否存在碘离子 | |
| B. | 用分液漏斗分离水与乙醇的混合物 | |
| C. | 用氯化钡溶液鉴别碳酸钠溶液与硫酸钠溶液 | |
| D. | 用排饱和食盐水集气法收集氯气 |
15.下列各物质投入水中,使溶液呈酸性的是( )
| A. | NaOH | B. | NH3 | C. | CH3COONa | D. | NH4Cl |
12.某有机物的结构简式如图所示,有关该有机物的叙述不正确的是( )
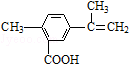

| A. | 在一定条件下,能发生取代、氧化和加聚反应 | |
| B. | 该物质分子中最多可以有11个碳原子在同一平面上 | |
| C. | 1 mol该物质最多可与5 mol H2发生加成反应 | |
| D. | 1 mol该物质完全氧化最多可消耗13 mol氧气 |
19.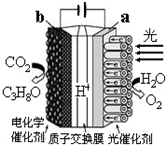 某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和C3H8O.下列说法错误的是( )
某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和C3H8O.下列说法错误的是( )
 某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和C3H8O.下列说法错误的是( )
某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和C3H8O.下列说法错误的是( )| A. | 该装置将光能和电能转化为化学能 | |
| B. | 该装置工作时,H+从a极区向b极区迁移 | |
| C. | 每还原44 g CO2,理论上可生成33.6L O2 | |
| D. | b电极的反应为:3CO2+18H++18e-═C3H8O+5H2O |
13. 某温度时,在1L恒容密闭容器中X、Y、Z三种气体的物质的量随时间变化曲线如图所示,以下说法正确的是( )
某温度时,在1L恒容密闭容器中X、Y、Z三种气体的物质的量随时间变化曲线如图所示,以下说法正确的是( )
 某温度时,在1L恒容密闭容器中X、Y、Z三种气体的物质的量随时间变化曲线如图所示,以下说法正确的是( )
某温度时,在1L恒容密闭容器中X、Y、Z三种气体的物质的量随时间变化曲线如图所示,以下说法正确的是( )| A. | 反应开始至2min,反应的平均速率v(Z)=0.2mol/L | |
| B. | 该反应的化学方程式为X+3Y═2Z | |
| C. | 该反应平衡时,Y转化率为30% | |
| D. | 3min时,充入X,v正增大,v逆减小 |