题目内容
19.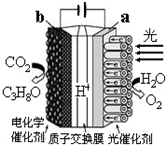 某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和C3H8O.下列说法错误的是( )
某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和C3H8O.下列说法错误的是( )| A. | 该装置将光能和电能转化为化学能 | |
| B. | 该装置工作时,H+从a极区向b极区迁移 | |
| C. | 每还原44 g CO2,理论上可生成33.6L O2 | |
| D. | b电极的反应为:3CO2+18H++18e-═C3H8O+5H2O |
分析 A、该装置是电解装置,据此判断能量转化形式;
B、与电源正极相连的是电解池的阳极,负极相连的是电解池的阴极,a与电源正极相连,所以a是阳极,而电解池中氢离子向阴极移动;
C、电池总的方程式为:6CO2+8H2O$\frac{\underline{\;通电\;}}{\;}$2C3H8O+9O2,即生成9mol的氧气,阴极有6mol的二氧化碳被还原,由此分析解答;
D、与电源负极相连的是阴极,发生还原反应.
解答 解:A、该电解装置是将光能和电能转化为化学能的装置,故A正确;
B、a与电源正极相连,所以a是阳极,而电解池中氢离子向阴极移动,所以H+从阳极a极区向阴极b极区迁移,故B正确;
C、电池总的方程式为:6CO2+8H2O$\frac{\underline{\;通电\;}}{\;}$2C3H8O+9O2,即生成9mol的氧气,阴极有6mol的二氧化碳被还原,也就是1mol的氧气,阴极有$\frac{2}{3}$mol的二氧化碳被还原,每还原44g即1molCO2,理论上可生成O2是1,5mol,标况下的体积是33.6L,故C错误;
D、b与电源的负极相接,b是阴极,所以发生还原反应3CO2+18H++18e-═C3H8O+5H2O,故D正确;
故选CD.
点评 本题考查电化学的相关知识,学生要清楚电解池的反应原理,阴极发生还原反应,阳极发生氧化反应,以及离子的移动方向就可以迅速解题了,比较容易.

练习册系列答案
相关题目
9.在元素周期表短周期元素中,X元素与Y、Z、W三元素相邻,X、Y的原子序数之和等于Z的原子序数,这四种元素原子的最外层电子数之和为20.下列判断一定正确的是( )
| A. | 单质熔点:Z>W | B. | 离子半径:X<Y | ||
| C. | 氧化物对应水化物的酸性:X>Z | D. | X和Z可存在于同一离子化合物中 |
10.实验室可以用KMnO4标准液滴定草酸(H2C2O4),测定溶液中草酸的浓度.判断下列说法不正确的是( )
| A. | 滴定中涉及的离子方程式为:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O | |
| B. | KMnO4标准溶液常用硫酸酸化,若用HNO3酸化,会使测定结果偏低 | |
| C. | KMnO4标准溶液盛放在酸式滴定管中 | |
| D. | 该实验选择酚酞做指示剂,当待测液颜色由无色变为浅红色时即达到滴定终点 |
14.在相同温度、压强条件下,将同体积的CO2 分别通入下列溶液中,能得到 $HCO_3^-$浓度最大的是( )
| A. | 过量氨水溶液 | B. | 过量饱和Na2CO3 溶液 | ||
| C. | 过量CH3COOH 溶液 | D. | 过量蒸馏水 |
4.下列离子方程式正确的是( )
| A. | 过量氨水与氯化铝溶液反应:Al3++3OH-═Al(OH)3↓ | |
| B. | 氢氧化铝溶于稀盐酸中:H++OH-═H2O | |
| C. | 氢氧化铝溶于氢氧化钠溶液:Al(OH)3+OH-═AlO2-+2H2O | |
| D. | 过量氢氧化钠溶液与氯化铝溶液反应:Al3++3OH-═Al(OH)3↓ |
11.以NA表示阿伏加德罗常数,下列说法中正确的是( )
| A. | 53g碳酸钠中含NA个CO32- | |
| B. | 0.1molOH-含NA电子 | |
| C. | 22.4LHCl溶于水,溶液中H+数为NA | |
| D. | 标准状况下11.2L臭氧(O3)中含NA个氧原子 |
8.NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 1 mol氢氧根离子与1mol羟基所含电子数均为10NA | |
| B. | 2.8gN2和CO的混合物中,所含分子总数为0.2NA | |
| C. | 标准状况下,11.2L甲醛气体所含共用电子对数目为2NA | |
| D. | 2.24 L CO2与足量的Na2O2反应,转移的电子总数必为0.1NA |
 研究工业废弃物的处理和防治具有重要的意义.
研究工业废弃物的处理和防治具有重要的意义.