题目内容
13. 某温度时,在1L恒容密闭容器中X、Y、Z三种气体的物质的量随时间变化曲线如图所示,以下说法正确的是( )
某温度时,在1L恒容密闭容器中X、Y、Z三种气体的物质的量随时间变化曲线如图所示,以下说法正确的是( )| A. | 反应开始至2min,反应的平均速率v(Z)=0.2mol/L | |
| B. | 该反应的化学方程式为X+3Y═2Z | |
| C. | 该反应平衡时,Y转化率为30% | |
| D. | 3min时,充入X,v正增大,v逆减小 |
分析 A.根据v=$\frac{△c}{△t}$计算反应速率,注意反应速率的单位;
B.根据物质的量的变化判断反应物和生成物,根据物质的量的变化之比等于化学计量数之比书写方程式,注意该反应为可逆反应,应该用可逆号;
C.根据图象计算出反应消耗Y的物质的量,然后计算出其转化率;
D.充入X的瞬间正反应速率增大,逆反应速率不变,之后正反应速率逐渐减小,逆反应速率逐渐增大,之至达到新的平衡.
解答 解:A.反应开始至2min时,Z的物质的量为0.2mol,则v(Z)=$\frac{\frac{0.2mol}{1L}}{2min}$=0.1mol/(L•min),故A错误;
B.由图象可以看出,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,且△n(X):△n(Y):△n(Z)=0.1mol:0.3mol:0.2mol=1:3:2,则该反应的化学方程式为:X+3Y?2Z,故B错误;
C.平衡时Y的物质的量为0.7mol,反应消耗的Y为:1.0mol-0.7mol=0.3mol,则Y的转化率为:$\frac{0.3mol}{1.0mol}$×100%=30%,故C正确;
D.3min时充入X的瞬间,v正增大,v逆不变,之后正反应速率逐渐减小,逆反应速率逐渐增大,之至达到新的平衡状态,故D错误;
故选C.
点评 本题考查化学平衡图象分析、化学平衡的计算,题目难度中等,注意分析各物质的量的变化曲线,把握化学方程式的判断方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
3.用NA表示阿伏伽德罗常数的值,下列叙述中正确的是( )
| A. | 常温常压下,11.2L一氧化碳和二氧化碳混合气体中含有的碳原子数目为0.5NA | |
| B. | 标准状况下,7.1克氯气与足量的氢氧化钠溶液反应转移的电子数位0.2NA | |
| C. | 92克二氧化氮和四氧化二氮的混合气体中含有的原子总数为6NA | |
| D. | 1.5mol/L氯化钙溶液中含有氯离子数目为3NA |
4.下列离子方程式正确的是( )
| A. | 过量氨水与氯化铝溶液反应:Al3++3OH-═Al(OH)3↓ | |
| B. | 氢氧化铝溶于稀盐酸中:H++OH-═H2O | |
| C. | 氢氧化铝溶于氢氧化钠溶液:Al(OH)3+OH-═AlO2-+2H2O | |
| D. | 过量氢氧化钠溶液与氯化铝溶液反应:Al3++3OH-═Al(OH)3↓ |
1.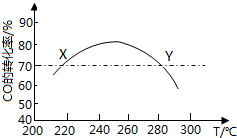 工业上,利用CO和H2合成二甲醚:3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)在合适的温度下,研究者进行了多次实验,每次实验保持原料气组成(3molCO、3molH2)、体积(10L)、反应时间等因素不变,实验结果如图所示.下列说法正确的是( )
工业上,利用CO和H2合成二甲醚:3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)在合适的温度下,研究者进行了多次实验,每次实验保持原料气组成(3molCO、3molH2)、体积(10L)、反应时间等因素不变,实验结果如图所示.下列说法正确的是( )
 工业上,利用CO和H2合成二甲醚:3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)在合适的温度下,研究者进行了多次实验,每次实验保持原料气组成(3molCO、3molH2)、体积(10L)、反应时间等因素不变,实验结果如图所示.下列说法正确的是( )
工业上,利用CO和H2合成二甲醚:3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)在合适的温度下,研究者进行了多次实验,每次实验保持原料气组成(3molCO、3molH2)、体积(10L)、反应时间等因素不变,实验结果如图所示.下列说法正确的是( )| A. | X、Y两点对应的CO正反应速率相等 | |
| B. | 合成二甲醚的正反应△H>0 | |
| C. | 反应温度应控制在240℃~260℃之间 | |
| D. | 选择合适催化剂,可以提高CO转化率 |
8.NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 1 mol氢氧根离子与1mol羟基所含电子数均为10NA | |
| B. | 2.8gN2和CO的混合物中,所含分子总数为0.2NA | |
| C. | 标准状况下,11.2L甲醛气体所含共用电子对数目为2NA | |
| D. | 2.24 L CO2与足量的Na2O2反应,转移的电子总数必为0.1NA |
18.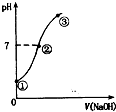 常温下,向饱和氯水中逐滴滴入0.1mol•L-1的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )
常温下,向饱和氯水中逐滴滴入0.1mol•L-1的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )
 常温下,向饱和氯水中逐滴滴入0.1mol•L-1的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )
常温下,向饱和氯水中逐滴滴入0.1mol•L-1的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )| A. | ①点所示溶液中只存在HCl0的电离平衡 | |
| B. | ②到③的过程中水的电离程度一定减少 | |
| C. | ②点处表示氯气与氢氧化钠溶液恰好反应完全 | |
| D. | ②点所示溶液中:c( Na+)=c(HCl0)+2c(ClO -) |
5.有机物W的分子式为C5H10O2,一定条件下等量的W分别与Na,NaHCO3溶液反应均能产生气体,且生成气体体积比(同温同压)为1:2,则W的结构最多有几种(不考虑立体异构)( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
6.实验室制备硝基苯的反应原理和实验装置如图:

存在的主要副反应有:在温度稍高的情况下会生成间二硝基苯.
有关数据列如表:
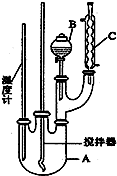
实验步骤如下:
取100mL烧杯,用20mL浓硫酸与18mL浓硝酸配制混和酸,将混合酸小心加入B中.把18mL(15.84g)苯加入A中.向室温下的苯中逐滴加入混酸,边滴边搅拌,混和均匀.在50~60℃下发生反应,直至反应结束.
将反应液冷却至室温后倒入分液漏斗中,依次用少量水、5%NaOH溶液和水洗涤.分出的产物加入无水CaCl2颗粒,静置片刻,弃去CaCl2,进行蒸馏纯化,收集205~210℃馏分,得到纯硝基苯18g.
回答下列问题:
(1)装置B的名称是分液漏斗.装置C的作用是冷凝回流.
(2)配制混合酸时,能否将浓硝酸加入到浓硫酸中,说明理由:不能,容易发生迸溅.
(3)为了使反应在50℃~60℃下进行,常用的方法是水浴加热.
(4)在洗涤操作中,第二次水洗的作用是洗去残留的NaOH及生成的盐.
(5)在蒸馏纯化过程中,因硝基苯的沸点高于140℃,应选用空气冷凝管,不选用直形冷凝管的原因是以免直形冷凝管通水冷却时导致温差过大而发生炸裂.
(6)本实验所得到的硝基苯产率是72%.

存在的主要副反应有:在温度稍高的情况下会生成间二硝基苯.
有关数据列如表:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 间二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸 | 83 | 1.4 | 易溶于水 | |
| 浓硫酸 | 338 | 1.84 | 易溶于水 |

实验步骤如下:
取100mL烧杯,用20mL浓硫酸与18mL浓硝酸配制混和酸,将混合酸小心加入B中.把18mL(15.84g)苯加入A中.向室温下的苯中逐滴加入混酸,边滴边搅拌,混和均匀.在50~60℃下发生反应,直至反应结束.
将反应液冷却至室温后倒入分液漏斗中,依次用少量水、5%NaOH溶液和水洗涤.分出的产物加入无水CaCl2颗粒,静置片刻,弃去CaCl2,进行蒸馏纯化,收集205~210℃馏分,得到纯硝基苯18g.
回答下列问题:
(1)装置B的名称是分液漏斗.装置C的作用是冷凝回流.
(2)配制混合酸时,能否将浓硝酸加入到浓硫酸中,说明理由:不能,容易发生迸溅.
(3)为了使反应在50℃~60℃下进行,常用的方法是水浴加热.
(4)在洗涤操作中,第二次水洗的作用是洗去残留的NaOH及生成的盐.
(5)在蒸馏纯化过程中,因硝基苯的沸点高于140℃,应选用空气冷凝管,不选用直形冷凝管的原因是以免直形冷凝管通水冷却时导致温差过大而发生炸裂.
(6)本实验所得到的硝基苯产率是72%.
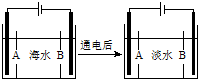 海南某小岛上,可利用的淡水资源相当匮乏,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验.
海南某小岛上,可利用的淡水资源相当匮乏,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验.