题目内容
9.碳及其化合物有广泛的用途.(1)反应C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是BC.
A.增加碳的用量 B.升高温度
C.用CO吸收剂除去CO D.加入催化剂
(2)已知,C(s)+CO2(g)?2CO(g)△H=+172.5kJ•mol-1则反应
CO(g)+H2O(g)?CO2(g)+H2(g) 的△H=-41.2kJ•mol-1.
(3)在一定温度下,将CO(g)和H2O(g)各0.16mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下数据:
| t/min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
②该温度下,此反应的平衡常数K=$\frac{9}{25}$;
③其它条件不变,再充入0.1mol CO和0.1mol H2O(g),达到平衡时CO的体积分数不变(填“增大”、“减小”或“不变”).
分析 (1)该反应是一个反应前后气体体积增大的吸热反应,升高温度、减小压强、减少生成物的量都能使平衡向正反应方向移动;
(2)利用盖斯定律构造目标热化学方程式,反应热也进行相应的运算;
(3)①正反应放热,降温时平衡正向移动;
②平衡常数表达式为K=$\frac{生成物浓度的幂次方}{反应物浓度的幂次方}$;
③反应前后气体体积不变,等比例加入反应物,平衡与原平衡等效.
解答 解:(1)A.增加碳的用量,浓度不变,平衡不移动,故错误;
B.升高温度,平衡正向移动,H2产率增大,故正确;
C.用CO吸收剂除去CO,平衡正向移动,H2产率增大,故正确;
D.加入催化剂,平衡不移动,故错误;
故选:BC;
(2)已知:①C(s)+H2O(g)?CO(g)+H2(g),△H=+131.3kJ•mol-1,
②C(s)+CO2(g)?2CO(g),△H=+172.5kJ•mol-1
根据盖斯定律,①-②得:CO(g)+H2O(g)?CO2(g)+H2(g),△H=131.3kJ•mol-1-172.5kJ•mol-1=-41.2kJ•mol-1,
故答案为:-41.2kJ•mol-1;
(3)①正反应放热,降温时平衡正向移动,v(正)>v(逆),
故答案为:<;
②CO和H2O反应了0.06mol,则CO2和H2生成了0.06mol,平衡时各物质的浓度为:反应物CO和H2O为0.05mol/L,生成物CO2和H2为0.03mol/L,平衡常数表达式为K=$\frac{生成物浓度的幂次方}{反应物浓度的幂次方}$=$\frac{0.03×0.03}{0.05×0.05}$=$\frac{9}{25}$,
故答案为:$\frac{9}{25}$;
③反应前后气体体积不变,与原平衡等比例加入反应物,平衡与原平衡等效,所以,平衡时各物质的浓度与原判断相同,
故答案为:不变.
点评 本题主要考查了平衡移动、盖斯定律应用、平衡常数的计算、等效平衡,题目难度中等.

 阶梯计算系列答案
阶梯计算系列答案| A. | I2升华 | B. | 烧碱熔化 | ||
| C. | HCl溶于水 | D. | 溴蒸气被活性炭吸附 |
| 元素编号 | 元 素 特 征 信 息 |
| A | 最外层电子数是次外层电子数的2倍 |
| B | 和E同主族 |
| C | 1mol C单质能与冷水反应,在标准状况下生成11.2L H2 |
| D | 原子最外层电子数等于其周期序数 |
| E | 负一价阴离子的电子层结构与Ar原子相同 |
 ,E在周期表中的位置为:第三周期第ⅦA族.
,E在周期表中的位置为:第三周期第ⅦA族.(2)B和C形成的化合物的电子式为:
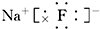 .
.(3)B和D简单离子的半径大小为:F->Al3+.
(4)元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中不可行的是:ae(填序号).
a.比较两种单质的颜色 b.比较两种单质与H2化合的难易程度
c.依据两元素在周期表中的位置 d.比较对应阴离子的还原性
e.比较最高价氧化物对应水化物的酸性
(5)E元素能与另外四种元素中的一种元素形成共价化合物,分子中的原子个数比1:4,相对分子质量为154,则该物质的化学式为:CCl4.
| A. | 原子半径:A<B<C<D | |
| B. | 非金属性:A<C | |
| C. | 最高价氧化物对应水化物的酸性:D>C | |
| D. | B的最高价氧化物对应的水化物为强碱 |
| A. | 食品添加剂既可以是天然物质,也可以是人工合成物质,两者使用时都要控制用量 | |
| B. | 形成酸雨的元凶主要有NOx、SO2、CO2等 | |
| C. | 人体的血脂高,是因为血液中含有的名为“血脂”的化学物质超标 | |
| D. | 我国古代化学即对人类做出了重大贡献,其中冶铁和炼钢就是其中之一,前者得到的是混合物,后者是将前者提纯得到纯净物 |
| A. | 降低温度可以加快反应速率 | |
| B. | 如果反应开始时加入2molN2和6molH2,则达到平衡时,n(N2):n(H2)=1:3 | |
| C. | 达到化学反应限度时,生成2mol NH3 | |
| D. | 1mol N2 和3mol H2的总能量低于2mol NH3的总能量 |
 航天发射的运载火箭常用燃料肼(N2H4)和强氧化剂过氧化氢,火箭部分构件采用钛合金材料,回答下列问题:
航天发射的运载火箭常用燃料肼(N2H4)和强氧化剂过氧化氢,火箭部分构件采用钛合金材料,回答下列问题:(1)N2H4、H2O2的组成元素中第一电离能最大的元素是N(填元素符号),1molN2H4分子中所含σ键的数目为5NA.
(2)基态钛原子的核外电子排布式为1s22s22p63s23p63d24s2,其未成对电子数为2.
(3)H2O2受热易分解为H2O,H2O的空间构型为V形,其中心原子的杂化轨道类型为sp3杂化,H2S和H2O2的主要物理性质如下表,造成二者物理性质差异的主要原因是H2O2的分子之间形成氢键,沸点高于硫化氢的,H2O2与H2O分子之间也可以形成氢键,H2O2在水中的溶解度大于H2S的.
| 熔点/K | 沸点/K | 水中溶解度(标准状况下) | |
| H2S | 187 | 202 | 每升水中溶解2.6L |
| H2O2 | 272 | 423 | 以任意比互溶 |
(5)立方氮化硼的晶胞如图所示,则处于晶胞顶点的原子的配位数为4,若晶胞边长为acm,则立方氮化硼的密度是$\frac{100}{{a}^{3}{N}_{A}}$g•cm-3(设NA为阿伏伽德罗常数的数值).
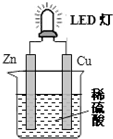
| A. | 锌是负极,电子从锌片经导线流向铜片 | |
| B. | 氢离子在铜片表面被还原 | |
| C. | 如果将硫酸换成橙汁,导线中不会有电子流动 | |
| D. | 装置中存在“化学能→电能→光能”的转换 |