题目内容
16.如图是课外活动小组设计的用化学电源使LED灯发光的装置.下列说法错误的是( )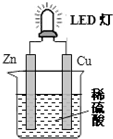
| A. | 锌是负极,电子从锌片经导线流向铜片 | |
| B. | 氢离子在铜片表面被还原 | |
| C. | 如果将硫酸换成橙汁,导线中不会有电子流动 | |
| D. | 装置中存在“化学能→电能→光能”的转换 |
分析 锌比铜活泼,形成原电池反应时,锌为负极,铜为正极,正极发生还原反应生成氢气,以此解答该题
解答 解:A.锌比铜活泼,形成原电池反应时,锌为负极,铜为正极,电子从负极锌片经导线流向正极铜片,故A正确;
B.铜锌原电池中,Cu作正极,溶液中的氢离子在正极上得电子生成氢气,所以Cu上有气泡生成,电极反应式为:2H++2e-=H2,故B正确;
C.橙汁显酸性也能作电解质溶液,所以将硫酸换成橙汁,仍然构成原电池,所以导线中有电子流动,故C错误;
D.原电池中化学能转化为电能,LED灯发光时,电能转化为光能,故D正确;
故选C.
点评 本题考查了原电池原理,明确正负极的判断方法以及能量的转化即可解答,可以从电子流向、电极上得失电子、电极上发生反应类型来判断正负极,难度不大.

练习册系列答案
相关题目
9.碳及其化合物有广泛的用途.
(1)反应C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是BC.
A.增加碳的用量 B.升高温度
C.用CO吸收剂除去CO D.加入催化剂
(2)已知,C(s)+CO2(g)?2CO(g)△H=+172.5kJ•mol-1则反应
CO(g)+H2O(g)?CO2(g)+H2(g) 的△H=-41.2kJ•mol-1.
(3)在一定温度下,将CO(g)和H2O(g)各0.16mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下数据:
①其它条件不变,降低温度,达到新平衡前v(逆)<v(正)(填“>”、“<”或“=”).
②该温度下,此反应的平衡常数K=$\frac{9}{25}$;
③其它条件不变,再充入0.1mol CO和0.1mol H2O(g),达到平衡时CO的体积分数不变(填“增大”、“减小”或“不变”).
(1)反应C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是BC.
A.增加碳的用量 B.升高温度
C.用CO吸收剂除去CO D.加入催化剂
(2)已知,C(s)+CO2(g)?2CO(g)△H=+172.5kJ•mol-1则反应
CO(g)+H2O(g)?CO2(g)+H2(g) 的△H=-41.2kJ•mol-1.
(3)在一定温度下,将CO(g)和H2O(g)各0.16mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下数据:
| t/min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
②该温度下,此反应的平衡常数K=$\frac{9}{25}$;
③其它条件不变,再充入0.1mol CO和0.1mol H2O(g),达到平衡时CO的体积分数不变(填“增大”、“减小”或“不变”).
4.两元素可以形成AB型离子化合物,它们的原子序数可能是( )
| A. | 1和17 | B. | 12和9 | C. | 11和16 | D. | 12和8 |
11.不能使酸性KMnO4溶液褪色的是( )
| A. | 甲苯 | B. | 聚乙烯 | C. | SO2 | D. | 乙炔 |
1.能正确表示下列化学反应的离子方程式是( )
| A. | 碳酸钙与醋酸反应:CaCO3+2H+=Ca2++CO2↑+H2O | |
| B. | 氯气溶于水:Cl2+H2O?2H++Cl一+ClO一 | |
| C. | 过量二氧化碳与石灰水反应:CO2+2OH一=CO32一+H2O | |
| D. | 利用腐蚀法制作印刷线路板:2Fe3++Cu=2Fe2++Cu2+ |
8.下列有关金属镁说法不正确的是( )
| A. | Mg在CO2中燃烧生成MgO和C,是放热反应 | |
| B. | 工业上通过电解MgCl2溶液制取金属镁 | |
| C. | Mg和稀硫酸反应时,滴加少量硫酸铜溶液,能加快反应速率 | |
| D. | 镁可以用来制造信号弹和焰火,MgO可以作耐高温材料 |
5.下列实验事实:
①常温下S为固体,而Cl2为气体;
②Cl2与H2混合,强光照射剧烈反应,而S与H2反应需较高温度;
③Cl2与Fe反应,Cl2生成FeCl3,而S与Fe生成FeS;
④盐酸是强酸,而氢硫酸是弱酸;
⑤将Cl2通入氢硫酸中可置换出S
能说明Cl的非金属性比S强的事实有( )
①常温下S为固体,而Cl2为气体;
②Cl2与H2混合,强光照射剧烈反应,而S与H2反应需较高温度;
③Cl2与Fe反应,Cl2生成FeCl3,而S与Fe生成FeS;
④盐酸是强酸,而氢硫酸是弱酸;
⑤将Cl2通入氢硫酸中可置换出S
能说明Cl的非金属性比S强的事实有( )
| A. | ①③⑤ | B. | ②③④ | C. | ②③⑤ | D. | ②③④⑤ |
6.下列变化中,由取代反应引起的是( )
| A. | 乙烯通入酸性高锰酸钾溶液中,酸性高锰酸钾溶液褪色 | |
| B. | 在一定条件下,苯滴入浓硝酸和浓硫酸的混合液中,有油状物生成 | |
| C. | 在一定条件下,苯与氢气反应生成环己烷 | |
| D. | 在催化剂作用下,乙烯与水反应生成乙醇 |