题目内容
14.化学与人类生活密切相关,下列说法正确的是( )| A. | 食品添加剂既可以是天然物质,也可以是人工合成物质,两者使用时都要控制用量 | |
| B. | 形成酸雨的元凶主要有NOx、SO2、CO2等 | |
| C. | 人体的血脂高,是因为血液中含有的名为“血脂”的化学物质超标 | |
| D. | 我国古代化学即对人类做出了重大贡献,其中冶铁和炼钢就是其中之一,前者得到的是混合物,后者是将前者提纯得到纯净物 |
分析 A.食品添加剂是为改善食品色、香、味等品质,以及为防腐和加工工艺的需要而加入食品中的人工合成物质或者天然物质,过量食用食品添加剂对人体有害,应合理添加;
B.二氧化碳是温室气体,NOx、SO2是酸雨的形成的主要原因;
C.血脂中的主要成份甘油三酯;
D.纯净物是由一种物质组成的物质.混合物是由多种物质组成的物质.
解答 解:A.食品添加剂确实提高了现代食品的品质,但副作用也是显而易见的,安全合理使用食品添加剂非常重要,所以无论是天然物质,还是人工合成物质,两者使用时都要控制用量,故A正确;
B.二氧化硫是形成硫酸型酸雨的形成的主要原因,NOx是形成硝酸型酸雨的主要原因,二氧化碳是温室气体不是形成酸雨的元凶,故B错误;
C.人体的血脂高,是因为血液中含有的甘油三酯含量高,不是名为“血脂”的化学物质超标,故C错误;
D.不锈钢是铁的合金,炼钢不是将生铁提纯得到纯净物,而是降低生铁中碳的含量、除硫、磷含量,调节硅锰含量,故D错误;
故选A.
点评 本题考查了化学与人类生活密切相关知识,涉及食品添加剂、酸雨、血脂的成分、炼铁、炼钢等知识,掌握基础是解题关键,题目难度不大.

练习册系列答案
 名题金卷系列答案
名题金卷系列答案
相关题目
4.如图所示有关浓硫酸性质的实验装置中,实验开始一段时间后,对看到的现象叙述及原因解释都正确的是( )
| A. | 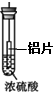 铝片无明显变化,说明浓硫酸与铝片不反应 | |
| B. | 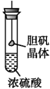 胆矾晶体表面有“白斑”,说明浓硫酸具有脱水性 | |
| C. | 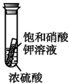 小试管内有晶体析出,说明浓硫酸具有吸水性 | |
| D. | 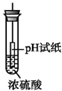 pH试纸变红,说明浓硫酸具有酸性 |
5. 盆烯是近年合成的一种有机物,它的分子结构可用如图表示(其中碳、氢原子均已略去),下面关于盆烯的说法错误的是( )
盆烯是近年合成的一种有机物,它的分子结构可用如图表示(其中碳、氢原子均已略去),下面关于盆烯的说法错误的是( )
 盆烯是近年合成的一种有机物,它的分子结构可用如图表示(其中碳、氢原子均已略去),下面关于盆烯的说法错误的是( )
盆烯是近年合成的一种有机物,它的分子结构可用如图表示(其中碳、氢原子均已略去),下面关于盆烯的说法错误的是( )| A. | 盆烯的分子中所有的碳原子共一平面 | |
| B. | 盆烯是苯的一种同分异构体 | |
| C. | 盆烯与乙烯的官能团相同 | |
| D. | 盆烯可以在一定条件下发生加成反应 |
2.下列反应既属于氧化还原反应,又是吸热反应的是( )
| A. | 灼热的碳与CO2的反应 | B. | Ba(OH)2•8H2O与NH4Cl的反应 | ||
| C. | 铝片与稀盐酸的反应 | D. | 甲烷在氧气中的燃烧反应 |
9.碳及其化合物有广泛的用途.
(1)反应C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是BC.
A.增加碳的用量 B.升高温度
C.用CO吸收剂除去CO D.加入催化剂
(2)已知,C(s)+CO2(g)?2CO(g)△H=+172.5kJ•mol-1则反应
CO(g)+H2O(g)?CO2(g)+H2(g) 的△H=-41.2kJ•mol-1.
(3)在一定温度下,将CO(g)和H2O(g)各0.16mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下数据:
①其它条件不变,降低温度,达到新平衡前v(逆)<v(正)(填“>”、“<”或“=”).
②该温度下,此反应的平衡常数K=$\frac{9}{25}$;
③其它条件不变,再充入0.1mol CO和0.1mol H2O(g),达到平衡时CO的体积分数不变(填“增大”、“减小”或“不变”).
(1)反应C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是BC.
A.增加碳的用量 B.升高温度
C.用CO吸收剂除去CO D.加入催化剂
(2)已知,C(s)+CO2(g)?2CO(g)△H=+172.5kJ•mol-1则反应
CO(g)+H2O(g)?CO2(g)+H2(g) 的△H=-41.2kJ•mol-1.
(3)在一定温度下,将CO(g)和H2O(g)各0.16mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下数据:
| t/min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
②该温度下,此反应的平衡常数K=$\frac{9}{25}$;
③其它条件不变,再充入0.1mol CO和0.1mol H2O(g),达到平衡时CO的体积分数不变(填“增大”、“减小”或“不变”).
19.适当温度下电解H2O-CO2混合气体可制得H2和CO,其电解原理如图所示,下列说法正确的是( )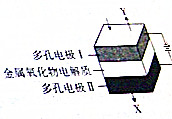

| A. | X的成分是H2和CO | |
| B. | 阳极的电极反应式为2O2--4e-=O2↑ | |
| C. | 电解质中的O2-移向电极I | |
| D. | 当阴极上有2mol气体生成时,通过电解质的电子数目为4NA |
3.以下有关接触法制硫酸的论述错误的是( )
| A. | 为提高反应速率和原料利用率,硫铁矿要在“沸腾”状态下燃烧 | |
| B. | 为防止催化剂中毒,气体在进接触室前要先净化 | |
| C. | 接触室中热交换器的主要作用是预热未反应的气体和冷却反应后的气体 | |
| D. | 吸收塔中SO3从下而上,水从上而下喷,剩余气体从上部出来循环利用 |
20.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4LN2中含有π健数为3NA | |
| B. | 12g金刚石中含有C-C键数为4NA | |
| C. | 25℃时,pH=12的CH3COONa溶液中水电离出的OH-的数目为0.01NA | |
| D. | 当反应3(NH4)2SO4$\frac{\underline{\;\;△\;\;}}{\;}$4NH3↑+3SO2↑+N2↑+6H2O生成89.6L标准状况的气体时,转移的电子数为3NA |
1.能正确表示下列化学反应的离子方程式是( )
| A. | 碳酸钙与醋酸反应:CaCO3+2H+=Ca2++CO2↑+H2O | |
| B. | 氯气溶于水:Cl2+H2O?2H++Cl一+ClO一 | |
| C. | 过量二氧化碳与石灰水反应:CO2+2OH一=CO32一+H2O | |
| D. | 利用腐蚀法制作印刷线路板:2Fe3++Cu=2Fe2++Cu2+ |