题目内容
4.由物质X合成乙烯雌酚Y的一种路线如下: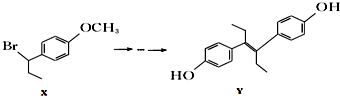
下列叙述正确的是( )
| A. | 化合物x中不含有手性碳原子 | |
| B. | 1mol化合物Y与浓溴水反应,最多消耗5mol Br2 | |
| C. | 在一定条件下化合物Y能发生加聚反应、缩聚反应 | |
| D. | 在氢氧化钠水溶液中加热,化合物X能发生消去反应 |
分析 A.化合物x中与Br相连的C连接4个不同基团;
B.化合物Y中含酚-OH和碳碳双键;
C.化合物Y中含酚-OH和碳碳双键;
D.氢氧化钠水溶液中加热,化合物X发生水解反应.
解答 解:A.化合物x中与Br相连的C连接4个不同基团,该碳原子为手性碳原子,故A错误;
B.化合物Y中含酚-OH和碳碳双键,则1mol化合物Y与浓溴水反应,最多消耗5mol Br2,故B正确;
C.化合物Y中含酚-OH可发生缩聚反应,含碳碳双键可发生加聚反应,故C正确;
D.氢氧化钠水溶液中加热,化合物X发生水解反应,在NaOH、醇溶液中加热发生消去反应,故D错误;
故选BC.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意酚、烯烃、卤代烃的性质,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.下列反应可用离子反应方程式2Ca2++3HCO3-+3OH-→2CaCO3↓+CO32-+3H2O表示的是( )
| A. | Ca(HCO3)2与NaOH溶液反应 | B. | Ca(HCO3)2与澄清石灰水反应 | ||
| C. | NaHCO3与澄清石灰水反应 | D. | NH4HCO3与澄清石灰水反应 |
12. 短周期元素甲~戊的原子序数依次增大,结合表中信息,回答有关问题.
短周期元素甲~戊的原子序数依次增大,结合表中信息,回答有关问题.
(1)基态乙原子,最外层有2个未成对电子,电子云形状有2种.
(2)丁元素与其同周期相邻两种元素原子的第一电离能由大到小的顺序为Mg>Al>Na(用元素符号表示),试解释原因Mg电子排布3s全满结构,第一电离能异常增大.
(3)由甲乙丙、甲丙戊组成的两种离子的钠盐可以反应,离子方程式是HCO3-+HSO3-=H2O+CO2↑+SO32-;HCO3-+H+=H2O+CO2↑.
(4)乙、戊在最高价酸根中的杂化类型分别是sp2、sp3.
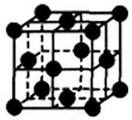
(5)单质铜晶体的堆积方式如图所示,设晶胞边长为a cm,阿伏伽德罗常数用NA表示,则晶胞中原子的配位数为12,晶体的密度为$\frac{256}{{a}^{3}{N}_{A}}$g•cm-3(要求写表达式,可以不简化).
 短周期元素甲~戊的原子序数依次增大,结合表中信息,回答有关问题.
短周期元素甲~戊的原子序数依次增大,结合表中信息,回答有关问题.| 甲 | 乙 | 丙 | 丁 | 戊 | |
| 主要化合价 | +1、-1 | +4、-4 | |||
| 性质或结构信息 | 同位素有3种 | 同素异形体有多种 | 2s22p4 | 五种原子中原子半径最大,未成对电子数为0 | 有两种常见氧化物,其中一种是大气污染物 |
(2)丁元素与其同周期相邻两种元素原子的第一电离能由大到小的顺序为Mg>Al>Na(用元素符号表示),试解释原因Mg电子排布3s全满结构,第一电离能异常增大.
(3)由甲乙丙、甲丙戊组成的两种离子的钠盐可以反应,离子方程式是HCO3-+HSO3-=H2O+CO2↑+SO32-;HCO3-+H+=H2O+CO2↑.
(4)乙、戊在最高价酸根中的杂化类型分别是sp2、sp3.
(5)单质铜晶体的堆积方式如图所示,设晶胞边长为a cm,阿伏伽德罗常数用NA表示,则晶胞中原子的配位数为12,晶体的密度为$\frac{256}{{a}^{3}{N}_{A}}$g•cm-3(要求写表达式,可以不简化).
19.下列实验操作不正确的是( )
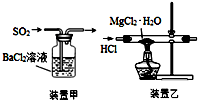

| A. | 焰色反应实验时,在蘸取待测液前,先用稀盐酸洗净铂丝并灼烧至无色 | |
| B. | 将2.5gCuSO4•5H2O溶于水配成100.0mL溶液,得到0.1mol•L-1硫酸铜溶液 | |
| C. | 用装置甲吸收SO2 | |
| D. | 用装置乙制取无水MgCl2 |
2.甲、乙两化学兴趣小组安装两套如图1相同装置,用以探究影响H2O2分解速率的因素.
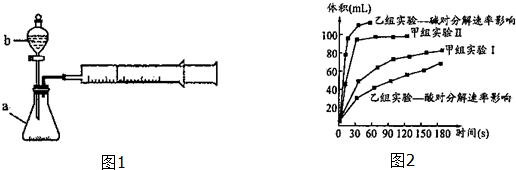
(1)仪器b的名称:分液漏斗.
(2)甲小组有如下实验设计方案,请帮助完成下列填空.
(3)甲、乙两小组得出如图2数据.
①由甲组实验得出的数据可知:浓度越大,H2O2分解速率越快(填“越快”、“越慢”);
②由乙组研究的酸、碱对H2O2分解影响因素的数据分析相同条件下,Na2O2和K2O2溶于水放出气体速率较快的是K2O2;
③乙组提出可以用BaO2固体与H2SO4溶液反应制H2O2,其化学反应方程式为Ba02+H2SO4=H202+BaSO4↓;支持这一方案的理由是制备H202的环境为酸性环境,H202分解速率较慢.

(1)仪器b的名称:分液漏斗.
(2)甲小组有如下实验设计方案,请帮助完成下列填空.
| 实验编号 | 实验目的 | t℃ | 催化剂 | 浓度 |
| 甲组实验Ⅰ | 做实验参照 | 25 | 3滴FeCl3溶液 | 10ml 2%H2O2 |
| 甲组实验Ⅱ | 探究浓度对速率的影响 | 25 | 10ml 5%H2O2 |
①由甲组实验得出的数据可知:浓度越大,H2O2分解速率越快(填“越快”、“越慢”);
②由乙组研究的酸、碱对H2O2分解影响因素的数据分析相同条件下,Na2O2和K2O2溶于水放出气体速率较快的是K2O2;
③乙组提出可以用BaO2固体与H2SO4溶液反应制H2O2,其化学反应方程式为Ba02+H2SO4=H202+BaSO4↓;支持这一方案的理由是制备H202的环境为酸性环境,H202分解速率较慢.
3.在5ml 0.1mol/L KI溶液中滴加0.1mol/LFeCl3溶液5-6滴后,再进行下列实验,其中可证明FeC13溶液和KI溶液的反应是可逆反应的实验是( )
| A. | 再滴加AgNO3溶液,观察是否有AgI沉淀产生 | |
| B. | 加入CC14振荡后,观察下层液体颜色 | |
| C. | 加入CC14振荡后,取上层清液,滴加AgNO3溶液,观察是否有AgCl沉淀产生 | |
| D. | 加入CC14振荡后,取上层清液,滴加KSCN溶液,观察是否有血红色 |
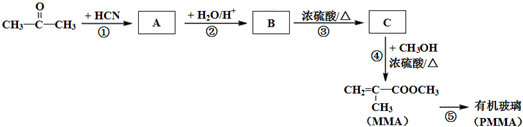
 $\stackrel{+HCN}{→}$
$\stackrel{+HCN}{→}$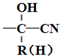
 .
. .
.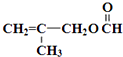
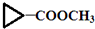
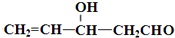
 )”的合成路线(试剂及溶剂任选;合成路线参照“已知”中的书写形式)
)”的合成路线(试剂及溶剂任选;合成路线参照“已知”中的书写形式) .
.