题目内容
7.下列实验操作、现象和结论均正确的是( )| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将浓氨水加到盛有AgCl固体的试管中 | AgCl固体完全溶解 | 所得溶液中c(Ag+)•c(Cl-) ≤Ksp(AgCl) |
| B | 向FeI2溶液中通入少量的氯气,再向反应后的溶液中滴加KSCN溶液 | 溶液变为红色 | Cl2能将Fe2+氧化成Fe3+ |
| C | 向固体纯碱中滴加足量浓盐酸,将产生的气体通入苯酚钠溶液 | 溶液变浑浊 | 酸性:盐酸>碳酸>苯酚 |
| D | 向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液 | 均有固体析出 | 蛋白质均发生变性 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.AgCl溶解是因发生络合反应;
B.向FeI2溶液中通入少量的氯气,先氧化碘离子;
C.盐酸易挥发,生成的二氧化碳气体中含有HCl;
D.根据浓的无机盐溶液能使蛋白质发生盐析,而重金属盐能使蛋白质发生变性.
解答 解:A.将氨水加到盛有AgCl固体的试管中,AgCl固体完全溶解,因发生络合反应生成氢氧化二氨合银,溶液中c(Ag+)•c(Cl-)≤Ksp(AgCl),故A正确;
B.向FeI2溶液中通入少量的氯气,先氧化碘离子,向反应后的溶液中滴加KSCN溶液,结果溶液不会变为红色,故B错误;
C.由于是浓盐酸,可以挥发出HCl,可以使苯酚钠生成苯酚,所以只能证明盐酸酸性强于碳酸,故C错误;
D.因浓的无机盐溶液能使蛋白质发生盐析产生沉淀,如饱和硫酸钠溶液、硫酸铵溶液;而重金属盐能使蛋白质发生变性而产生沉淀,如硫酸铜等,故D错误.
故选A.
点评 本题考查化学实验方案评价,为高频考点,涉及离子的检验、沉淀生成及蛋白质变性等,把握反应原理及反应与现象的关系为解答的关键,注意从实验的评价性及物质性质分析解答,题目难度不大.

练习册系列答案
相关题目
17.海洋资源有巨大的开发潜力,人类正着力进行海水的综合利用.
(1)以海水为原料生产海盐过程中产生苦卤(含Na+、K+、Mg2+、Cl-、Br-等离子).从苦卤中可提取溴,其生产流程如下:
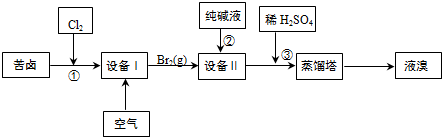
①在设备Ⅰ中用空气吹出Br2,并在设备Ⅱ中用纯碱溶液吸收,发生反应的离子方程式为3CO32-+3Br2=5Br-+BrO3-+3CO2↑,若吸收1mol Br2,转移的电子数为$\frac{5}{3}$mol.
②所用的设备名称为(填序号):设备ⅠB设备ⅡA
A.吸收塔 B.吹出塔 C.分馏塔 D.压滤机
③步骤③中发生反应的离子方程式为BrO3-+5Br-+6H+=3Br2+3H2O.
④蒸馏塔中蒸馏温度控制在90℃左右的原因是顺利将溴蒸出,同时防止水馏出.
(2)从海水中提取镁的工艺流程如下:
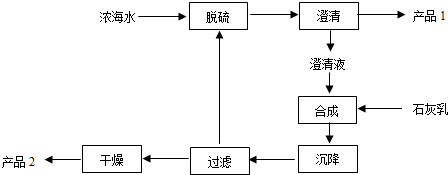
浓海水中的离子浓度如下:
产品1是脱硫阶段产生的沉淀,其主要成分的化学式为CaSO4,1L浓海水最多可得到产品2的质量为69.6g.
(3)下列改进和优化海水综合利用工艺的设想和做法可行的是②③④(填序号)
①用混凝法获取淡水 ②提高部分产品的质量
③优化提取产品的品种 ④改进钾、溴、镁的提取工艺.
(1)以海水为原料生产海盐过程中产生苦卤(含Na+、K+、Mg2+、Cl-、Br-等离子).从苦卤中可提取溴,其生产流程如下:

①在设备Ⅰ中用空气吹出Br2,并在设备Ⅱ中用纯碱溶液吸收,发生反应的离子方程式为3CO32-+3Br2=5Br-+BrO3-+3CO2↑,若吸收1mol Br2,转移的电子数为$\frac{5}{3}$mol.
②所用的设备名称为(填序号):设备ⅠB设备ⅡA
A.吸收塔 B.吹出塔 C.分馏塔 D.压滤机
③步骤③中发生反应的离子方程式为BrO3-+5Br-+6H+=3Br2+3H2O.
④蒸馏塔中蒸馏温度控制在90℃左右的原因是顺利将溴蒸出,同时防止水馏出.
(2)从海水中提取镁的工艺流程如下:

浓海水中的离子浓度如下:
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
(3)下列改进和优化海水综合利用工艺的设想和做法可行的是②③④(填序号)
①用混凝法获取淡水 ②提高部分产品的质量
③优化提取产品的品种 ④改进钾、溴、镁的提取工艺.
18.某小组同学在实验室里对Fe3+与I-的反应进行探究,实现Fe3+与Fe2+相互转化.
(1)甲同学首先进行了如下实验:
实验Ⅰ中发生反应的离子方程式为2Fe2++Cl2═2Fe3++2Cl-,Fe3++3SCN-=Fe(SCN)3.
(2)实验II的现象与预测不同,为探究可能的原因,甲同学又进行了如下实验,
操作及现象如下:
根据实验Ⅲ,该同学认为Fe3+有可能与I-发生氧化还原反应.请结合实验现象说明得出该结论的理由:溶液变成黄色,推测生成了I2.
(3)乙同学认为,还需要进一步设计实验才可证明根据实验Ⅲ中现象得出的结论.
请补全下表中的实验方案:
(4)上述实验结果表明,Fe3+有可能与I-发生氧化还原反应.进一步查阅资料知,参加反应的Fe3+和I-物质的量相同.该小组同学结合上述实验结论,分析了实验Ⅲ中加入KSCN后溶液变血红色的原因,认为Fe3+与I-反应的离子方程式应写为:2Fe3++2I-?2Fe2++I2.
(1)甲同学首先进行了如下实验:
| 编号 | 操作 | 现象 |
| Ⅰ | 先向2mL0.1mol•L-1FeCl2溶液中滴加KSCN溶液,再滴加新制氯水 | 滴加KSCN后溶液无明显变化, 加入氯水后溶液变成血红色. |
| Ⅱ | 先向2mL0.1mol•L-1FeCl3溶液中滴加KSCN溶液,再滴加0.1mol•L-1KI溶液 | 滴加KSCN溶液后,溶液变成血红色;滴加0.1mol•L-1KI溶液后,血红色无明显变化 |
(2)实验II的现象与预测不同,为探究可能的原因,甲同学又进行了如下实验,
操作及现象如下:
| 编号 | 操作 | 现象 |
| Ⅲ | 向2mL0.1mol•L-1KI溶液中滴加1mL 0.1mol•L-1FeCl3溶液,再滴加KSCN溶液 | 滴加FeCl3溶液后,溶液变成黄色;滴加KSCN溶液后,溶液变成血红色 |
(3)乙同学认为,还需要进一步设计实验才可证明根据实验Ⅲ中现象得出的结论.
请补全下表中的实验方案:
| 编号 | 操作 | 预期现象及结论 |
| Ⅳ | 向2mL0.1mol•L-1KI溶液中滴加1mL 0.1mol•L-1 FeCl3,溶液变黄色,取该溶液于两支试管中, 试管①中滴加滴加淀粉溶液(或CCl4), 试管②中滴加滴加铁氰化钾溶液. | 预期现象①溶液变蓝 (或溶液分层,下层溶液为紫红色),②出现特征蓝色沉淀. 结论Fe3+能与I-发生氧化还原反应,生成I2和Fe2+. |
12. 短周期元素甲~戊的原子序数依次增大,结合表中信息,回答有关问题.
短周期元素甲~戊的原子序数依次增大,结合表中信息,回答有关问题.
(1)基态乙原子,最外层有2个未成对电子,电子云形状有2种.
(2)丁元素与其同周期相邻两种元素原子的第一电离能由大到小的顺序为Mg>Al>Na(用元素符号表示),试解释原因Mg电子排布3s全满结构,第一电离能异常增大.
(3)由甲乙丙、甲丙戊组成的两种离子的钠盐可以反应,离子方程式是HCO3-+HSO3-=H2O+CO2↑+SO32-;HCO3-+H+=H2O+CO2↑.
(4)乙、戊在最高价酸根中的杂化类型分别是sp2、sp3.
(5)单质铜晶体的堆积方式如图所示,设晶胞边长为a cm,阿伏伽德罗常数用NA表示,则晶胞中原子的配位数为12,晶体的密度为$\frac{256}{{a}^{3}{N}_{A}}$g•cm-3(要求写表达式,可以不简化).
 短周期元素甲~戊的原子序数依次增大,结合表中信息,回答有关问题.
短周期元素甲~戊的原子序数依次增大,结合表中信息,回答有关问题.| 甲 | 乙 | 丙 | 丁 | 戊 | |
| 主要化合价 | +1、-1 | +4、-4 | |||
| 性质或结构信息 | 同位素有3种 | 同素异形体有多种 | 2s22p4 | 五种原子中原子半径最大,未成对电子数为0 | 有两种常见氧化物,其中一种是大气污染物 |
(2)丁元素与其同周期相邻两种元素原子的第一电离能由大到小的顺序为Mg>Al>Na(用元素符号表示),试解释原因Mg电子排布3s全满结构,第一电离能异常增大.
(3)由甲乙丙、甲丙戊组成的两种离子的钠盐可以反应,离子方程式是HCO3-+HSO3-=H2O+CO2↑+SO32-;HCO3-+H+=H2O+CO2↑.
(4)乙、戊在最高价酸根中的杂化类型分别是sp2、sp3.
(5)单质铜晶体的堆积方式如图所示,设晶胞边长为a cm,阿伏伽德罗常数用NA表示,则晶胞中原子的配位数为12,晶体的密度为$\frac{256}{{a}^{3}{N}_{A}}$g•cm-3(要求写表达式,可以不简化).
19.下列实验操作不正确的是( )
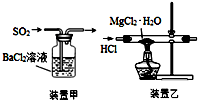

| A. | 焰色反应实验时,在蘸取待测液前,先用稀盐酸洗净铂丝并灼烧至无色 | |
| B. | 将2.5gCuSO4•5H2O溶于水配成100.0mL溶液,得到0.1mol•L-1硫酸铜溶液 | |
| C. | 用装置甲吸收SO2 | |
| D. | 用装置乙制取无水MgCl2 |
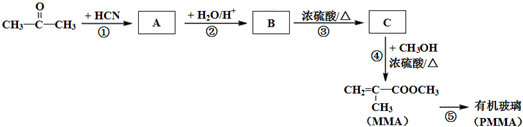
 $\stackrel{+HCN}{→}$
$\stackrel{+HCN}{→}$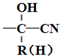
 .
. .
.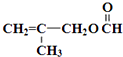
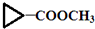
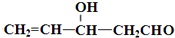
 )”的合成路线(试剂及溶剂任选;合成路线参照“已知”中的书写形式)
)”的合成路线(试剂及溶剂任选;合成路线参照“已知”中的书写形式) .
.
