题目内容
卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物.
(1)气态氟化氢中存在二聚分子(HF)2,这是由于 .
(2)I3+(可看成Ⅱ2+)属于多卤素阳离子,根据VSEPR模型推测I3+的空间构型为.
(3)基态溴原子的电子排布式为 .碘原子的价电子轨道排布式为 .
(4)卤素互化物如BrI、ICl等与卤素单质结构相似、性质相近.Cl2、BrI、ICl沸点由高到低的顺序为 .ICl与水反应的化学方程式为 .
(5)请推测 ①HClO4、②HIO4、③H5IO6[可写成(HO)5IO]三种物质的酸性由强到弱的顺序为 (填序号).
(6)卤化物RbICl2加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,A的化学式为 .
(1)气态氟化氢中存在二聚分子(HF)2,这是由于
(2)I3+(可看成Ⅱ2+)属于多卤素阳离子,根据VSEPR模型推测I3+的空间构型为.
(3)基态溴原子的电子排布式为
(4)卤素互化物如BrI、ICl等与卤素单质结构相似、性质相近.Cl2、BrI、ICl沸点由高到低的顺序为
(5)请推测 ①HClO4、②HIO4、③H5IO6[可写成(HO)5IO]三种物质的酸性由强到弱的顺序为
(6)卤化物RbICl2加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,A的化学式为
考点:氯、溴、碘及其化合物的综合应用,物质的组成、结构和性质的关系,原子核外电子排布,晶体熔沸点的比较,氢键的存在对物质性质的影响
专题:
分析:(1)F的电负性很大,HF分子之间形成氢键;
(2)I3+的成键数为2,孤对电子数为
×(7-1-2×1)=2,与水相似;
(3)Br的原子序数为35,最外层有7个电子,为4s、4p电子;碘原子价电子数与Br相同,为5s、5p电子;
(4)分子晶体,相对分子质量越大,沸点越高,原子的得电子能力越强,则电负性越大;
(5)含非羟基氧原子个数越多,酸性越强;
(6)根据元素守恒和原子守恒判断产物,及反应方程式;根据氯化钠的晶胞图分析;利用均摊法计算出晶胞中含有离子个数,再根据密度公式计算即可.
(2)I3+的成键数为2,孤对电子数为
| 1 |
| 2 |
(3)Br的原子序数为35,最外层有7个电子,为4s、4p电子;碘原子价电子数与Br相同,为5s、5p电子;
(4)分子晶体,相对分子质量越大,沸点越高,原子的得电子能力越强,则电负性越大;
(5)含非羟基氧原子个数越多,酸性越强;
(6)根据元素守恒和原子守恒判断产物,及反应方程式;根据氯化钠的晶胞图分析;利用均摊法计算出晶胞中含有离子个数,再根据密度公式计算即可.
解答:
解:(1)F的电负性很大,HF分子之间形成氢键,故答案为:HF分子间形成氢键;
(2)I3+的成键数为2,孤对电子数为
×(7-1-2×1)=2,与水相似,则空间构型为V形,中心I原子的杂化轨道类型为sp3,故答案为:V形;
(3)Br的原子序数为35,最外层有7个电子,为4s、4p电子,则电子排布式为[Ar]3d104s24p5,碘原子价电子的电子排布图为 ,;
,;
答案为:[Ar]3d104s24p5; ;
;
(4)分子晶体,相对分子质量越大,沸点越高,则沸点为BrI>ICl>Cl2,氯原子得电子能力强于I,所以Cl的电负性大,Cl显-1价,故I显+1价,ICl与水反应的化学方程式为:ICl+H2O═HCl+HIO;
故答案为:BrI>ICl>Cl2; ICl+H2O═HCl+HIO;
(5)含非羟基氧原子个数越多,酸性越强,非羟基氧分别为3、3、1,但非金属性Cl>I,则酸性为①②③,故答案为:①②③;
(6)卤化物RbICl2加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,根据元素守恒和原子守恒判断产物为RbCl和ICl,A为RbCl;
故答案为:RbCl;
(2)I3+的成键数为2,孤对电子数为
| 1 |
| 2 |
(3)Br的原子序数为35,最外层有7个电子,为4s、4p电子,则电子排布式为[Ar]3d104s24p5,碘原子价电子的电子排布图为
 ,;
,;答案为:[Ar]3d104s24p5;
 ;
;(4)分子晶体,相对分子质量越大,沸点越高,则沸点为BrI>ICl>Cl2,氯原子得电子能力强于I,所以Cl的电负性大,Cl显-1价,故I显+1价,ICl与水反应的化学方程式为:ICl+H2O═HCl+HIO;
故答案为:BrI>ICl>Cl2; ICl+H2O═HCl+HIO;
(5)含非羟基氧原子个数越多,酸性越强,非羟基氧分别为3、3、1,但非金属性Cl>I,则酸性为①②③,故答案为:①②③;
(6)卤化物RbICl2加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,根据元素守恒和原子守恒判断产物为RbCl和ICl,A为RbCl;
故答案为:RbCl;
点评:本题考查了核外电子排布式的书写、物质结构的理解等知识点,难度较大,原子结构特征是解此题关键.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
向浓度为0.1mol?L-1的K2CO3溶液中分别加入下列物质,能使C(CO32-)增大的是( )
| A、H2O |
| B、CO2 |
| C、KHSO4固体 |
| D、KOH固体 |
下列说法不正确的是( )
A、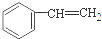 没有顺反异构体 没有顺反异构体 |
| B、1,3-丁二烯可以作为合成高分子化合物的原料 |
| C、用乙醇和浓硫酸制备乙烯时,用水浴加热控制反应温度 |
| D、常温下,将苯酚加入到少量水中有浑浊,滴入适量NaOH溶液后浑浊消失 |
E、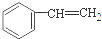 |
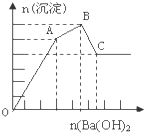 向FeCl3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如图所示.沉淀的生成与溶解的pH列于下表.以下推断错误的是( )
向FeCl3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如图所示.沉淀的生成与溶解的pH列于下表.以下推断错误的是( ) | 氢氧化物 | 溶液PH | |||
| 开始沉淀 | 沉淀完全 | 沉淀开始溶解 | 沉淀完全溶解 | |
| Fe(OH)2 | 2.3 | 3.4 | - | - |
| Al(OH)2 | 3.3 | 5.2 | 7.8 | 12.8 |
| A、C点的沉淀为:Fe(OH)3和 BaSO4 |
| B、OA段可能发生的反应有:3Ba2++6OH-+3SO42-+Al3++Fe3+→3BaSO4↓+Fe(OH)3↓+Al(OH)3↓ |
| C、AB段可能发生的反应是:2SO42-+2Ba2++Al3++3OH-→2BaSO4↓+Al(OH)3↓ |
| D、据图计算原溶液中c(Cl-)=c(SO42-) |
向一定量的Fe、FeO、Fe3O4和Fe2O3的混合物中加入250mL 4mol/L的稀硝酸,恰好使混合物完全溶解.放出2.24L NO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现,若用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量为( )
| A、0.21mol |
| B、0.25mol |
| C、0.45mol |
| D、0.5mol |
第ⅠA族元素具有相似的化学性质,是由于它们的原子具有相同的( )
| A、原子半径 | B、电子层数 |
| C、核外电子数 | D、最外层电子数 |
下列各种溶液中通入足量的SO2后,既无沉淀又无气体产生的是( )
①NaClO ②C6H5ONa ③Na2S ④BaCl2 ⑤Ba(OH)2 ⑥H2O2.
①NaClO ②C6H5ONa ③Na2S ④BaCl2 ⑤Ba(OH)2 ⑥H2O2.
| A、①④⑥ | B、①②③ |
| C、④⑤⑥ | D、①④⑤⑥ |