题目内容
17.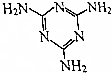 三聚氰胺的结构式如图所示,尿素[CO(NH2)2]在一定条件下发生分解反应可制得三聚氰胺和CO2等物质,下列说法不正确的是( )
三聚氰胺的结构式如图所示,尿素[CO(NH2)2]在一定条件下发生分解反应可制得三聚氰胺和CO2等物质,下列说法不正确的是( )| A. | 三聚氰胺的分子式为C3H6N6 | |
| B. | 氰胺的结构简式为H2N-C≡N | |
| C. | 尿素分解制三聚氰胺时,除生成CO2外,还会生成NH3 | |
| D. | 三聚氰胺属于高分子化合物 |
分析 A.根据结构简式确定分子式;
B.氰胺含有氨基和C≡N键;
C.根据质量守恒判断;
D.根据高分子化合物的定义判断.
解答 解:A.由三聚氰酸的结构简式可知,其分子式为C3H3N3O3,故A正确;
B.氰胺含有氨基和C≡N键,结构简式为H2N-C≡N,故B正确;
C.尿素[CO(NH2)2]在一定条件下反应生成三聚氰胺,同时放出氨气和二氧化碳气体的反应方程式:6CO(NH2)2=C3H6N6+6NH3↑+3CO2↑,故C正确;
D.高分子化合物的相对分子质量在10000以上,三聚氰胺不属于高分子化合物,故D错误.
故选D.
点评 本题考查有机物结构与性质,为高频考点,侧重对基础知识的巩固,涉及化学键、高分子化合物等考查,难度不大.

练习册系列答案
相关题目
7.下列各种符合题设环境的溶液中,能够大量共存的离子组是( )
| A. | 碱性溶液中:Mg2+、Fe3+、SO42-、Cl- | |
| B. | 酸性溶液中:NH4+、Na+、ClO-、SO42- | |
| C. | 透明溶液中:MnO4-、K+、Na+、NO3- | |
| D. | 滴入KSCN溶液显红色的溶液中:Na+、K+、SO42-、OH- |
5.下表是元素周期表的一部分,回答下列问题:
(1)在这些元素中,F(用元素符号填写,下同)是最活泼的非金属元素;Ar是最不活泼的元素.
(2)这些元素的最高价氧化物的对应水化物中HClO4酸性最强;能形成两性氢氧化物的元素是Al.
(3)从⑤到⑪的元素中,Cl原子半径最小,写出③形成的氢化物的电子式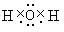 .
.
(4)⑥、⑩的最高价氧化物分别属于离子、共价型化合物(填离子,共价)
(5)比较⑤与⑥的化学性质,钠更活泼,试用实验证明(简述简单操作、主要现象和结论)取少量金属钠和金属镁,都投入冷水中,金属钠和冷水剧烈反应,生成无色气体,钠迅速消失. 而镁和冷水几乎不反应,无明显现象,证明了金属钠比金属镁活泼.
| 周期/族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ○ |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ⑪ | ⑫ |
(2)这些元素的最高价氧化物的对应水化物中HClO4酸性最强;能形成两性氢氧化物的元素是Al.
(3)从⑤到⑪的元素中,Cl原子半径最小,写出③形成的氢化物的电子式
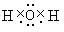 .
.(4)⑥、⑩的最高价氧化物分别属于离子、共价型化合物(填离子,共价)
(5)比较⑤与⑥的化学性质,钠更活泼,试用实验证明(简述简单操作、主要现象和结论)取少量金属钠和金属镁,都投入冷水中,金属钠和冷水剧烈反应,生成无色气体,钠迅速消失. 而镁和冷水几乎不反应,无明显现象,证明了金属钠比金属镁活泼.
12.已知括号中为杂质,则下列除杂试剂正确的是( )
| A. | 丙烷(丙烯),酸性高锰酸钾溶液 | B. | 甲烷(乙炔),溴的四氯化碳溶液 | ||
| C. | 溴苯(溴),苯 | D. | 硝基苯(硝酸),苯和浓硫酸 |
9.设NA为阿伏伽德罗常数的值,下列叙述不正确的是( )
| A. | 1molNa与O2完全反应生成Na2O2和Na2O的混合物,转移电子的总数为NA | |
| B. | 室温下,31.0g白磷中含有的共价键数目为1.5NA | |
| C. | 常温常压下,17g甲基(-14CH3)含有的电子数为9NA | |
| D. | 常温下,1.0L pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA |
8.钛被称为“第三金属”,其制取原料为金红石(TiO2),制取步骤为:
TiO2-→TiCl4$\stackrel{酶/800℃/Ar}{→}$Ti
已知:①C(s)+O2(g)═CO2(g)△H1
②2CO(g)+O2(g)═2CO2(g)△H2
③TiO2(s)+2Cl2(g)═TiCl4(s)+O2(g)△H3
则反应TiO2(s)+2Cl2(g)+2C(s)═TiCl4(s)+2CO(g)的△H为( )
TiO2-→TiCl4$\stackrel{酶/800℃/Ar}{→}$Ti
已知:①C(s)+O2(g)═CO2(g)△H1
②2CO(g)+O2(g)═2CO2(g)△H2
③TiO2(s)+2Cl2(g)═TiCl4(s)+O2(g)△H3
则反应TiO2(s)+2Cl2(g)+2C(s)═TiCl4(s)+2CO(g)的△H为( )
| A. | △H3+2△H1+2△H2 | B. | △H3+2△H1+△H2 | C. | △H3+2△H1-△H2 | D. | △H3+2△H1-2△H2 |
9.某化学兴趣小组欲研究一种镁铝合金,以下是部分实验.请完成填空.
[实验一]从镁铝合金片上剪下一小块,先称重,然后投到盛有10mL 10mol•L-1NaOH溶液(足量)的锥形瓶里.
(1)从反应开始至反应结束,依次可观察到的现象有:①切口断面处先产生气泡,反应由慢到快;②小块合金在溶液中上下翻腾;③溶液升温;④反应后,溶液中残留黑色固体.
(2)开始时产生气泡速率慢,其主要原因(除温度、电化学因素外)是合金表面有氧化膜.
(3)欲利用此反应测定合金中铝的含量,请仿照方法①写出另一种不同方法所需数据.
[实验二]向实验一的锥形瓶里滴加1mol•L-1HCl,使镁、铝两种元素恰好只以氯化物的形式存在.
[实验三]请设计合理实验检验实验二所得溶液中的Mg2+、Al3+.
限选实验用品与试剂:烧杯、试管、滴管、1mol•L-1NaOH溶液、1mol•L-1HCl溶液、蒸馏水.
根据你设计的实验方案,叙述实验操作、预期现象和结论.(可填满、可不填满)
[实验四]粉末状试样A是由MgO和Fe2O3组成的混合物.取适量A进行铝热反应,产物中有单质B生成.
产物中的单质B是Fe(填化学式).
[实验一]从镁铝合金片上剪下一小块,先称重,然后投到盛有10mL 10mol•L-1NaOH溶液(足量)的锥形瓶里.
(1)从反应开始至反应结束,依次可观察到的现象有:①切口断面处先产生气泡,反应由慢到快;②小块合金在溶液中上下翻腾;③溶液升温;④反应后,溶液中残留黑色固体.
(2)开始时产生气泡速率慢,其主要原因(除温度、电化学因素外)是合金表面有氧化膜.
(3)欲利用此反应测定合金中铝的含量,请仿照方法①写出另一种不同方法所需数据.
| 方法 | 需测定的数据 |
| ① | 测定产生的H2的体积 |
| ② | “测定残留固体镁的质量”或“测定反应消耗或剩余的NaOH的量”或“测定生成的NaAlO2的量” |
[实验三]请设计合理实验检验实验二所得溶液中的Mg2+、Al3+.
限选实验用品与试剂:烧杯、试管、滴管、1mol•L-1NaOH溶液、1mol•L-1HCl溶液、蒸馏水.
根据你设计的实验方案,叙述实验操作、预期现象和结论.(可填满、可不填满)
| 实验操作 | 预期现象和结论 |
| 步骤1: | |
| 步骤2: | |
| … |
产物中的单质B是Fe(填化学式).