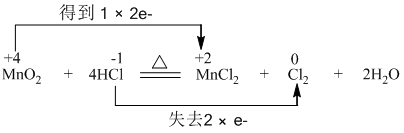
题目内容
7.下列各种符合题设环境的溶液中,能够大量共存的离子组是( )| A. | 碱性溶液中:Mg2+、Fe3+、SO42-、Cl- | |
| B. | 酸性溶液中:NH4+、Na+、ClO-、SO42- | |
| C. | 透明溶液中:MnO4-、K+、Na+、NO3- | |
| D. | 滴入KSCN溶液显红色的溶液中:Na+、K+、SO42-、OH- |
分析 A.镁离子、铁离子与碱性溶液中的氢氧根离子反应;
B.次氯酸根离子与酸性溶液中的氢离子结合生成次氯酸;
C.四种离子之间不反应,为透明溶液;
D.该溶液中存在铁离子,铁离子与氢氧根离子反应.
解答 解:A.碱性溶液中含有大量氢氧根离子,Mg2+、Fe3+与氢氧根离子反应,在溶液中不能大量共存,故A错误;
B.ClO-与酸性溶液中的氢离子结合生成弱电解质次氯酸,在溶液中不能大量共存,故B错误;
C.MnO4-、K+、Na+、NO3-之间不发生反应,在溶液中能够大量共存,故C正确;
D.滴入KSCN溶液显红色的溶液中含有Fe3+,Fe3+与OH-发生反应,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目
17.下列实验设计、操作或实验现象不合理的是( )
| A. | 实验室制取乙炔时,用饱和食盐水代替蒸馏水,以得到平稳的气流 | |
| B. | 检验甲酸中是否混有乙醛,可向样品中加入足量NaOH溶液以中和甲酸后,再做银镜反应实验或与新制Cu(OH)2共热的实验 | |
| C. | 除去苯中的少量苯酚:加入适量NaOH溶液,振荡、静置、分液 | |
| D. | 液态溴乙烷中加入稀NaOH溶液共煮几分钟,然后加入稀硝酸酸化,再加入AgNO3溶液检验溴乙烷中是否含有溴元素 |
18.下列叙述正确的是( )
| A. | 电子的能量越低,运动区域离核越远 | |
| B. | 当M层是最外层时,最多可排布18个电子 | |
| C. | 稀有气体元素原子的最外层都排有8个电子 | |
| D. | 核外电子的分层排布即是核外电子的分层运动 |
15. 以下元素均为短周期元素:
以下元素均为短周期元素:
(1)D的最低价含氧酸的电子式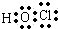 .
.
(2)M的简单气态氢化物与B的单质形成燃料电池(KOH为电解液),写出其负极反应方程式2NH3-6e-+6OH-═N2+6H2O.
(3)仅由A、B、E组成的一种生活中的常用盐,其中A的质量分数为43%,其水溶液与D单质物质的量比1:1反应的离子方程式为CO32-+Cl2+H2O=ClO-+Cl-+HCO-3.
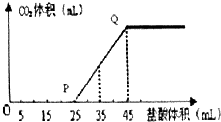
(4)A的最高价氧化物的水化物的溶液中通入一定量CO2得溶液X,X中逐滴加入1mol/L的盐酸,所加盐酸的体积与产生CO2的体积(标准状况)关系如图所示:
①X溶液中溶质的化学式NaOH和Na2CO3.
②当加入35mL盐酸时,产生CO2的体积为224mL(标准状况).
 以下元素均为短周期元素:
以下元素均为短周期元素:| 元素代号 | 相关信息 |
| M | 非金属元素,其气态氢化物的水溶液呈碱性 |
| A | A的单质能与冷水剧烈反应,得到强碱性溶液 |
| B | B的原子最外层电子数是其内层电子数的三倍 |
| C | 在第三周期元素中,C的简单离子半径最小 |
| D | A、B、D组成的36电子的化合物X是常用消毒剂的主要成分 |
| E | 所有有机物中都含有E元素 |
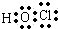 .
.(2)M的简单气态氢化物与B的单质形成燃料电池(KOH为电解液),写出其负极反应方程式2NH3-6e-+6OH-═N2+6H2O.
(3)仅由A、B、E组成的一种生活中的常用盐,其中A的质量分数为43%,其水溶液与D单质物质的量比1:1反应的离子方程式为CO32-+Cl2+H2O=ClO-+Cl-+HCO-3.
(4)A的最高价氧化物的水化物的溶液中通入一定量CO2得溶液X,X中逐滴加入1mol/L的盐酸,所加盐酸的体积与产生CO2的体积(标准状况)关系如图所示:
①X溶液中溶质的化学式NaOH和Na2CO3.
②当加入35mL盐酸时,产生CO2的体积为224mL(标准状况).
2.下列反应不属于取代反应的是( )
| A. |  +HNO3$→_{55-60℃}^{浓H_{2}SO_{4}}$ +HNO3$→_{55-60℃}^{浓H_{2}SO_{4}}$ +H2O +H2O | B. | CH2═CH2+H2$\stackrel{催化剂}{→}$CH3-CH3 | ||
| C. | CH3-CH3+Cl2$\stackrel{光照}{→}$CH3-CH2Cl+HCl | D. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl |
12.生物燃料电池是以有机物为燃料,直接或间接利用酶作为催化剂的一类特殊的燃料电池,其能量转化率高,是一种真正意义上的绿色电池,其工作原理如图所示.已知C1极的电极反应为C2H5OH+3H2O-12e-═2CO2+12H+.下列说法中不正确的是( )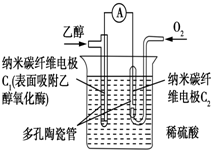

| A. | C1极为电池负极,C2极为电池正极 | |
| B. | 溶液中的H+向C1电极移动 | |
| C. | 该生物燃料电池的总反应方程式为C2H5OH+3O2═2CO2+3H2O | |
| D. | 电流由C2极经外电路流向C1极 |
17.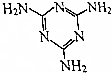 三聚氰胺的结构式如图所示,尿素[CO(NH2)2]在一定条件下发生分解反应可制得三聚氰胺和CO2等物质,下列说法不正确的是( )
三聚氰胺的结构式如图所示,尿素[CO(NH2)2]在一定条件下发生分解反应可制得三聚氰胺和CO2等物质,下列说法不正确的是( )
 三聚氰胺的结构式如图所示,尿素[CO(NH2)2]在一定条件下发生分解反应可制得三聚氰胺和CO2等物质,下列说法不正确的是( )
三聚氰胺的结构式如图所示,尿素[CO(NH2)2]在一定条件下发生分解反应可制得三聚氰胺和CO2等物质,下列说法不正确的是( )| A. | 三聚氰胺的分子式为C3H6N6 | |
| B. | 氰胺的结构简式为H2N-C≡N | |
| C. | 尿素分解制三聚氰胺时,除生成CO2外,还会生成NH3 | |
| D. | 三聚氰胺属于高分子化合物 |