题目内容
9.酸牛奶中含有乳酸.它可由乙烯来合成,方法如下: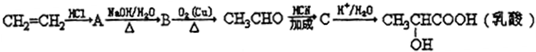
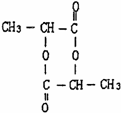
(1)乳酸自身在不同条件下可形成不同的酯,写出下列结构简式:两分子成环酯
 、两分子成链状酯
、两分子成链状酯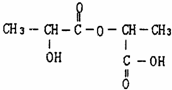 .
.(2)写出下列转化的化学方程式:
A的生成CH2=CH2+HCl→CH3CH2Cl.
CH3CHO的生成CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
C的生成CH3CHO+HCN$\stackrel{一定条件下}{→}$CH3CH(OH)CN.
(3)A→B的反应类型为取代反应.
分析 由合成流程可知,乙烯与HCl加成反应生成CH3CH2Cl,A水解生成B为CH3CH2OH,B氧化生成乙醛,乙醛与HCN发生加成反应生成C为CH3CH(OH)CN,C酸化生成乳酸,然后结合有机物的结构与性质来解答.
解答 解:由合成流程可知,乙烯与HCl加成反应生成CH3CH2Cl,A水解生成B为CH3CH2OH,B氧化生成乙醛,乙醛与HCN发生加成反应生成C为CH3CH(OH)CN,C酸化生成乳酸,
(1)两分子乳酸成环酯的结构为 , 两分子乳酸成链状酯的结构为
, 两分子乳酸成链状酯的结构为 ,
,
故答案为: ;
; ;
;
(2)生成A的反应为CH2=CH2+HCl→CH3CH2Cl,生成乙醛的反应为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,生成C的反应为CH3CHO+HCN$\stackrel{一定条件下}{→}$CH3CH(OH)CN,
故答案为:CH2=CH2+HCl→CH3CH2Cl;CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;CH3CHO+HCN$\stackrel{一定条件下}{→}$CH3CH(OH)CN;
(3)A水解生成B,所以A→B的反应类型为取代反应,故答案为:取代反应.
点评 本题考查有机物的合成,为高频考点,把握烯烃、醇、醛的性质及合成流程为解答的关键,注意官能团与性质的关系、结构与性质的关系及习题中信息,题目难度不大.

练习册系列答案
相关题目
19.实验室用锌与稀硫酸反应制取H2,欲使产生H2的速率加快,下列措施可行的是( )
| A. | 加水稀释 | B. | 加少量NaOH溶液 | C. | 改用98%的浓硫酸 | D. | 锌片改为锌粒 |
20.某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )

| A. | b、c三点溶液的离子浓度之和c>b>a | |
| B. | b点溶液中c(H+)+c(NH3•H2O)=(OH-) | |
| C. | 用等浓度的NaOH溶液和等体积b、c处溶液反应,恰好反应时消耗NaOH溶液的体积Vb=Vc | |
| D. | a、b、c三点溶液中水的电离程度a>b>c |
17.下列关于同分异构体、同系物的说法和判断中,正确的是( )
| A. | C2H4和C3H6一定属于同系物 | |
| B. | 淀粉[(C6H10O5)n]与纤维素[(C6H10O5)n]互为同分异构体 | |
| C. | 同系物之间化学性质相似,物理性质递变 | |
| D. | 同分异构体之间化学性质相似,物理性质递变 |
4.下列叙述中,正确的是( )
| A. | 在一个基态多电子的原子中,可以有两个运动状态完全相同的电子 | |
| B. | 在一个基态多电子的原子中,不可能有两个能量完全相同的电子 | |
| C. | NF3和BF3是中心原子杂化类型相同的极性分子 | |
| D. | 在SiO2晶体中,Si原子与Si-O键数目比为1:4 |
1.下列物质反应后的溶液中加入KSCN溶液一定会变红色的( )
| A. | Fe2O3与HCl反应 | B. | 过量铁粉与稀硝酸反应 | ||
| C. | 少量铁粉与稀盐酸作用 | D. | 铁粉与CuSO4反应 |
18.回答下列问题
(1)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域.单位质量的A和B单质燃烧时均放出大量热,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
①某同学根据上述信息,推断B的核外电子排布如图1所示,该同学所画的电子排布图违背能量最低原理,B元素位于周期表五个区域中的s区

②ACl2分子中A的杂化类型为sp杂化,ACl2的空间构型为直线形.
(2)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物.
①以体心立方堆积形成的金属铁中,其原子的配位数为8.
②写出一种与CN-互为等电子体的单质的电子式 .
.
③六氰合亚铁离子[Fe(CN)6]4-中不存在B.
A.共价键 B.非极性键 C.配位键 D.σ键 E.π键
(3)一种Al-Fe合金的立体晶胞如图2所示.请据此回答下列问题:
①确定该合金的化学式Fe2Al.
②若晶体的密度=ρ g/cm3,则此合金中最近的两个Fe原子之间的距离(用含ρ的代数式表示,不必化简)为$\root{3}{\frac{139}{2ρ{N}_{A}}}$cm.
(1)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域.单位质量的A和B单质燃烧时均放出大量热,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15399 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |

②ACl2分子中A的杂化类型为sp杂化,ACl2的空间构型为直线形.
(2)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物.
①以体心立方堆积形成的金属铁中,其原子的配位数为8.
②写出一种与CN-互为等电子体的单质的电子式
 .
.③六氰合亚铁离子[Fe(CN)6]4-中不存在B.
A.共价键 B.非极性键 C.配位键 D.σ键 E.π键
(3)一种Al-Fe合金的立体晶胞如图2所示.请据此回答下列问题:
①确定该合金的化学式Fe2Al.
②若晶体的密度=ρ g/cm3,则此合金中最近的两个Fe原子之间的距离(用含ρ的代数式表示,不必化简)为$\root{3}{\frac{139}{2ρ{N}_{A}}}$cm.
19.下列叙述中,正确的是( )
| A. | 在水溶液中或熔融状态下能导电的化合物是电解质 | |
| B. | 三氧化硫溶于水后,溶液能导电,三氧化硫是电解质 | |
| C. | 硝酸钾在电流作用下电离出钾离子和硝酸根离子 | |
| D. | 溶于水后能电离出氢离子的化合物都是酸 |