题目内容
19.实验室用锌与稀硫酸反应制取H2,欲使产生H2的速率加快,下列措施可行的是( )| A. | 加水稀释 | B. | 加少量NaOH溶液 | C. | 改用98%的浓硫酸 | D. | 锌片改为锌粒 |
分析 对于锌与稀硫酸的反应,影响反应速率的因素有浓度、温度以及固体表面积等,一般来说,增大浓度、升高温度或增大固体表面积等,可增大反应速率,以此解答.
解答 解:A.加水稀释液,溶液体积增大,浓度减小,反应速率减小,故A错误;
B.滴加少量NaOH溶液,溶液体积增大,浓度减小,反应速率减小,故B错误;
C.改用98%的浓硫酸不生成氢气,故C错误;
D.锌片改为锌粉,固体表面积增大,反应速率增大,故D正确.
故选D.
点评 本题考查化学反应速率的影响因素,为高频考点,侧重于基础知识的综合理解和运用的考查,注意相关基础知识的积累,难度不大.

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目
7.下列离子方程式书写正确的是( )
| A. | 碳酸钙与盐酸反应:CO32-+2H+=CO2↑+H2O | |
| B. | Ba(OH)2与H2SO4两稀溶液混合:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| C. | AlCl3溶液中加入过量氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| D. | 铝与NaOH溶液反应:2Al+2OH-=2AlO2-+3H2↑ |
14.下列说法不正确的是( )
| A. | 已知冰的熔化热为6.0 kJ•mol-1,冰中氢键键能为20 kJ•mol-1,假设1 mol 冰中有2 mol氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15%的氢键 | |
| B. | 已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为a,电离常数K$\frac{(ca)^{2}}{c(1-a)}$=.若加水稀释,则CH3COOH?CH3C00-+H+向右移动,a增大,Ka不变 | |
| C. | 甲烷的标准燃烧热为-890.3 kjJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH3 (g)+202(g)-C02(g)+2H20(1)△H=-890.3 kJ•mol-1 | |
| D. | 500℃、30 MPa下,将0.5 mol N和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)$?_{500℃,30MPa}^{催化剂}$2NH3(g)△H=-38.6kJ•mol-1 |
11.化学科学需要借助化学专用语言描述,下列有关化学用语正确的是( )
| A. | CO2的电子式: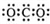 | B. | 8个中子的碳原子的符号:12C | ||
| C. | 次氯酸分子的结构式:H-O-Cl | D. | 乙烯的结构简式:CH2CH2 |
8.已知反应A+B=C+D的能量变化如图所示,下列说法不正确的是( )


| A. | 只有在加热条件下该反应才能进行 | |
| B. | 该反应是吸热反应 | |
| C. | 反应物的总能量低于生成物的总能量 | |
| D. | 反应中断开化学键吸收的总能量高于形成化学键放出的总能量 |

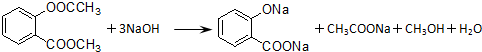 .
. .
.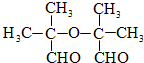
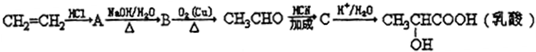
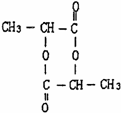 、两分子成链状酯
、两分子成链状酯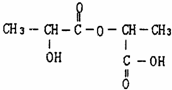 .
.