题目内容
16.硅是无极非金属材料的主角,下列物质含有硅单质的是( )| A | B | C | D |
 |  |  |  |
| 光导纤维 | 太阳能电池板 | 水玻璃 | 水晶 |
| A. | A | B. | B | C. | C | D. | D |
分析 硅位于金属和非金属分界线附近,常用作半导体材料,为无机非金属材料的主角,而二氧化硅具有熔点高、硬度大的特点,常用于制备耐高温材料和光导纤维.
解答 解:A、光导纤维是二氧化硅,故A不选;
B、硅是半导体,用于太阳能电池板的材料,故B选;
C、水玻璃的成份是硅酸钠,故C不选;
D、水晶的主要成份是二氧化硅,故D不选;
故选B.
点评 本题考查硅及其化合物的性质及应用,题目难度不大,注意基础知识的积累.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.类比推理是常用的思维方法,下列几种类比推理正确的是( )
| A. | CO2是直线型分子,推测CS2是直线型分子 | |
| B. | Cl?与Fe3+共存,推测I?与Fe3+共存 | |
| C. | H2SO4为强酸,推测HC1O为强酸 | |
| D. | 蒸干Al2(SO4)3溶液得到Al2(SO4)3固体,推测蒸干AlCl3溶液得到AlCl3固体 |
7.如图是电解 CuCl2溶液的装置,其中 c、d 为石墨电极.则下列有关的判断正确的是( )
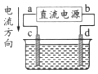

| A. | a 为负极、b 为正极 | B. | a 为阳极、b 为阴极 | ||
| C. | 电解过程中,d 电极质量增加 | D. | 电解过程中,氯离子浓度不变 |
4.下列物质中含有共价键的、离子键的离子化合物是( )
| A. | H2O | B. | CaCl2 | C. | Ba(OH)2 | D. | H2 |
11.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 28g N2含有的原子数为NA | |
| B. | 标准状况下22.4L水中含有的H20分子数为NA | |
| C. | 6.5gZn均足量盐酸反应失去的电子数为0.2NA | |
| D. | 2mol•L-1NaCl溶液中含有Na+个数为2NA |
1.下列变化,通过一步反应不能实现的是( )
| A. | Na→Na2O2 | B. | SiO2→H2SiO3 | C. | Fe(OH)2→Fe(OH)3 | D. | Cu→CuCl2 |
8.用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 71gCl2中含有的原子数目为NA | |
| B. | 1mol•L-1H2SO4溶液中含有SO42-数目为NA | |
| C. | 56g铁完全反应时,可能失去的电子数目为2NA或3NA | |
| D. | 常温常压下,44.8L氯化氢气体含有的分子数目为2NA |
5.下列物质与用途对应关系正确的是( )
| A. | 明矾--自来水消毒剂 | B. | 碘单质--加碘盐添加剂 | ||
| C. | 聚氯乙烯--食品保鲜膜 | D. | SO2--葡萄酒防腐剂 |
6.高铁酸钠(Na2FeO4)是一种高效的饮用水处理剂,可由下列方法制得:2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O,关于该反应说法正确的是( )
| A. | Fe(OH)3中铁元素化合价为+3,只有氧化性 | |
| B. | 反应中NaClO是氧化剂,NaCl是氧化产物 | |
| C. | 生成1 mol Na2FeO4,有6mol 电子转移 | |
| D. | Na2FeO4具有强氧化性,能消毒杀菌 |