题目内容
17.根据要求回答下列问题:(1)如图所示,某同学设计一个甲醚(CH3OCH3)燃料电池并探究氯碱工业原理和粗铜的精炼原理,乙装置中X为阳离子交换膜
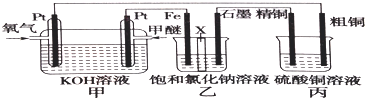
①通入氧气的电极为正极(填“正极”或“负极”),写出负极的电极反应式CH3OCH3+16OH--12e-═2CO32-+22H2O
CH3OCH3+16OH--12e-═2CO32-+22H2O.
②铁电极为阴极(填“阴极”或“阳极”),石墨电极的电极反应式2Cl--2e-═Cl2↑
2Cl--2e-═Cl2↑.反应一段时间后,乙装置中生成的氢氧化钠主要在铁极(填“铁极”或“石墨极”)区.
③如果粗铜中含有锌、银等杂质,则丙装置中硫酸铜溶液的浓度将减小(填“增大”、“减小”或“不变”).
④若在标准状况下有2.24L氧气参与反应,则乙装置中铁电极上生成的气体在标况下的体积为4.48L;丙装置中阴极析出铜的质量为12.8g.
(2)某兴趣小组在常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池,测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气产生
 .
.0~t1时,原电池的负极是Al片,此时,正极的电极反应式为NO3-+e-+2H+═NO2↑+H2O,(提示:此时正极是NO3-放电),溶液中的H+向正极移动.t1后,原电池中电流方向发生改变,其原因是Al表面钝化后,Al与硝酸反应逐渐停止,Cu与浓硝酸开始反应,故这时候Cu为负极,Al为正极,电流发生了改变.
分析 (1)①燃料电池中通入氧气的电极是正极,正极上得电子发生还原反应,负极上燃料失电子发生氧化反应;
②铁电极作阴极,碳作阳极,电解氯化钠饱和溶液时,阳极上氯离子放电;乙装置为电解氯化钠装置,氢氧化钠在阴极生成;
③粗铜精炼时,粗铜作阳极,阳极上金属失电子,阴极上铜离子得电子,根据阴阳极上金属的变化确定溶液中铜离子是否变化;
④根据串联电池中转移电子数相等计算铁电极上生成氢气的体积、丙装置中析出铜的质量;
(2)0-t1时,Al在浓硝酸中发生钝化过程,Al为负极,氧化得到氧化铝,应有水参加,根据电荷守恒可知,有氢离子生成,Cu为正极,硝酸根放电生成二氧化氮,应由氢离子参与反应,同时有水生成,随着反应进行铝表面钝化形成氧化膜阻碍反应进行,t1时,铜做负极反应,Al为正极.
解答 解:(1)①燃料电池中通入氧化剂氧气的电极是正极,正极上得电子发生还原反应,负极上燃料失电子和氢氧根离子发生氧化反应生成水,电极反应式为CH3OCH3+16OH--12e-═2CO32-+22H2O,故答案为:正极;CH3OCH3+16OH--12e-═2CO32-+22H2O;
②铁电极连接原电池负极而作电解池阴极,碳作阳极,电解氯化钠饱和溶液时,阳极上氯离子放电,电极反应式为2Cl--2e-=Cl2↑,
故答案为:阴极;2Cl--2e-=Cl2↑;
③如果粗铜中含有锌、银等杂质,阳极上不仅铜还有锌失电子进入溶液,银沉积在阳极附近,形成电极泥,阴极上析出铜,根据转移电子数相等知,阳极上溶解的铜小于阴极上析出的铜,所以丙装置中反应一段时间,硫酸铜溶液浓度将减小,故答案为:减小;
④串联电池中转移电子数相等,若在标准状况下,有2.24L氧气参加反应,则转移电子的物质的量=$\frac{2.24L}{22.4L/mol}$,乙装置中铁电极上氢离子放电生成氢气,设生成氢气的体积为xL;丙装置中阴极上析出铜,设析出铜的质量为yg.
2H++2e-=H2↑
2mol 22.4L
0.4mol xL
x=4.48
2Cu 2++2e-=Cu
2mol 64g
0.4mol yg
y=12.8
故答案为:4.48;12.8;
(2)0-t1时,Al在浓硝酸中发生钝化过程,Al为负极,氧化得到氧化铝,应有水参加,根据电荷守恒可知,有氢离子生成,Cu为正极,硝酸根放电生成二氧化氮,应由氢离子参与反应,同时有水生成,正极电极反应式为:2H++NO3-+e-=NO2↑+H2O,溶液中的H+向正极移动;Al表面钝化后,Al与硝酸反应逐渐停止,Cu与浓硝酸开始反应,故这时候Cu为负极,Al为正极,电流发生了改变,
故答案为:2H++NO3-+e-=NO2↑+H2O;正;Al表面钝化后,Al与硝酸反应逐渐停止,Cu与浓硝酸开始反应,故这时候Cu为负极,Al为正极,电流发生了改变.
点评 本题考查原电池和电解池知识,为高考常见题型,侧重于学生的分析能力和计算能力的考查,注意把握电极方程式的书写,为解答该题的关键,结合串联电路的特点解答该题,难度不大.

 科学实验活动册系列答案
科学实验活动册系列答案| A. | 1H、D、T属于同一种核素 | |
| B. | 含有共价键的化合物一定是共价化合物 | |
| C. | NH4Cl的电子式为 | |
| D. | S2-的结构示意图为 |
| A. | 海带中提取碘的氧化过程:H2O2+2I-+2H+=I2+2H2O | |
| B. | 向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液至SO42-恰好沉淀完全:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O | |
| C. | FeCl3溶液中通入过量的H2S气体:2Fe3++H2S=S↓+2Fe2++2H+ | |
| D. |  溶液通入少量CO2: 溶液通入少量CO2: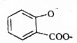 +CO2+H2O→ +CO2+H2O→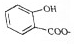 +HCO3- +HCO3- |
| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | 在共价化合物中一定含有共价键 | |
| C. | 离子化合物中只含有离子键 | |
| D. | 化学键断裂的变化一定是化学变化 |
 硫酸工业生产应考虑综合经济效益问题.
硫酸工业生产应考虑综合经济效益问题.(1)若从下列四个城市中选择一处建一座硫酸厂,你认为厂址宜选在C的郊区(填标号).
A.有丰富黄铁矿资源的城市
B.风光秀丽的旅游城市
C.消耗硫酸甚多的工业城市
D.人口稠密的文化、商业中心城市
(2)CuFeS2是黄铁矿的另一成分,煅烧时CuFeS2转化为CuO、Fe2O3和SO2,该反应的化学方程式为4CuFeS2+13O2=4CuO+2Fe2O3+8SO2;
(3)为了有利于SO2转化SO3,多采用如图所示的装有多层催化剂的接触室(填设备名称)作为反应设备,让气体经历如图所示流程而不是直接进入该设备进行反应的原因是使热量能充分利用.
(4)在硫酸工业制法中,下列生产操作与说明生产操作的主要原因二者都是正确的是D
A.黄铁矿燃烧前需要粉碎,因为大块的黄铁矿不能在空气中 燃烧
B.从沸腾炉出来的炉气需净化,因为炉气中的二氧化硫会与杂质反应
C.二氧化硫氧化为三氧化硫时需使用催化剂,这样可以提高二氧化硫的转化率
D.三氧化硫用98.3%的浓硫酸吸收,目的是防止形成酸雾,以提高三氧化硫的吸收效率
(5)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据如表信息,结合工业生产实际,选择最合适的生产条件是400℃、1个大气压.
| 1个大气压 | 5个大气压 | 10个大气压 | 15个大气压 | |
| 400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
| 500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
| 600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
(7)若用浓硫酸吸收SO3可以得到H2SO4•SO3.用1000g 98% 的H2SO4充分吸收SO3后,再进行稀释,可以得到98% 的硫酸的质量是C
A.1.98kg B.2.00kg C.2.22kg D.2.42kg.
| A. | Ba2+、K+、SO42- | B. | Ca2+、NO3-、Cl- | C. | Na+、Mg2+、OH- | D. | H+、Cl-、HCO3- |
| A. | 一定有乙烯 | B. | 一定有甲烷 | C. | 一定没有甲烷 | D. | 一定没有乙烯 |
| A. | 碳酸的电离方程式:H2CO3=2H++CO32- | |
| B. | F-的结构示意图: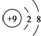 | |
| C. | ${\;}_{55}^{134}$Cs和${\;}_{55}^{137}$Cs形成的单质物理性质相同 | |
| D. | NH3 的电子式: |