题目内容
16.正确掌握化学用语是学好化学的基础,下列有关表述正确的是 ( )| A. | 1H、D、T属于同一种核素 | |
| B. | 含有共价键的化合物一定是共价化合物 | |
| C. | NH4Cl的电子式为 | |
| D. | S2-的结构示意图为 |
分析 A.具有一定质子数和中子数的原子为一种核素;
B.含有共价键的化合物不一定为共价化合物,如过氧化钠、氢氧化钠等;
C.氯离子为阴离子,电子式中没有标出最外层电子;
D.硫离子的核电荷数为16,最外层满足8电子稳定结构.
解答 解:A.1H、D、T为氢元素的3种核素,三者互为同位素,故A错误;
B.含有离子键的化合物一定为离子化合物,但是含有共价键的化合物不一定是共价化合物,如氢氧化钠、硫酸钠、过氧化钠等都属于离子化合物,它们都含有共价键,故B错误;
C.氯化铵是离子化合物,由氨根离子与氯离子构成,其正确的电子式为 ,故C错误;
,故C错误;
D.硫离子的核外电子总数为18,最外层达到8电子稳定结构,S2-的结构示意图为: ,故D正确;
,故D正确;
故选D.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及离子结构示意图、电子式、化学键、核素等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
1.下列关于原电池的说法错误的是( )


| A. | ①、②装置都能将化学能转化为电能 | |
| B. | ②中的硫酸根离子向负极移动 | |
| C. | ②中的电子轴Zn经过导线流向Cu | |
| D. | ②中铜片上发生的电极反应式为2H++2e-=2H2↑ |
8.许多著名化学家对化学的发展做出巨大贡献,下列有关化学家与他们的成就对化关系不正确的是( )
| A. | 侯德榜--创立了联合制碱法 | |
| B. | 凯库勒--首次提出了“有机化学”概念 | |
| C. | C维勒--首次用无机物合成了有机物 | |
| D. | 门捷列夫--创设了元素周期表 |
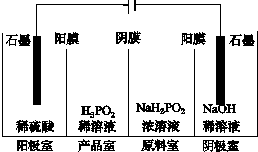 次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性.回答下列问题:
次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性.回答下列问题: .
.
 2011年9月29日我国成功发射的“天宫一号”飞行器的外壳覆盖了一种新型结构陶瓷材料,其主要成分是氮化硅,该陶瓷材料可由石英固体与焦炭颗粒在高温的氮气流中通过如下反应制得:
2011年9月29日我国成功发射的“天宫一号”飞行器的外壳覆盖了一种新型结构陶瓷材料,其主要成分是氮化硅,该陶瓷材料可由石英固体与焦炭颗粒在高温的氮气流中通过如下反应制得: 第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物.
第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物. .
.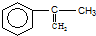 出发来合成A,其合成路线如下:
出发来合成A,其合成路线如下: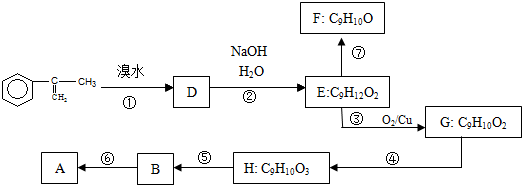
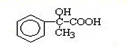
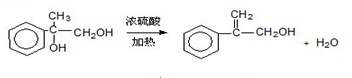 .两分子H之间发生反应生成六元环酯化学方程式是:2
.两分子H之间发生反应生成六元环酯化学方程式是:2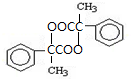 +2H2O.
+2H2O.
 .
.