题目内容
3.当原子核外M电子层为最外层时最多容纳的电子数是( )| A. | 2 | B. | 8 | C. | 16 | D. | 18 |
分析 由于能级交错的原因,End>E(n+1)s.当ns和np充满时(共4个轨道,最多容纳8个电子),多余电子不是填入nd,而是首先形成新电子层,填入(n+1)s轨道中,据此判断最外层最多容纳电子数.
解答 解:由于能级交错的原因,End>E(n+1)s,当ns和np充满时(共4个轨道,最多容纳8个电子),多余电子不是填入nd,而是首先形成新电子层,填入(n+1)s轨道中,因此当原子核外M电子层为最外层时最多容纳8个电子,
故选B.
点评 本题考查了核外电子的运动和电子排布规律,题目难度不大,明确原子核外电子排布规律为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
相关题目
14.25℃时,某溶液中由水电离产生的C(H+)和C(OH-)的乘积为1×10-20,下列说法正确的是( )
| A. | 该溶液的pH不可能是7 | B. | 该溶液的pH一定是4 | ||
| C. | 该溶液的pH一定是10 | D. | 不会有这样的溶液 |
11.“保护环境,就是保护自己.”目前,我国城市环境中主要的大气污染物是( )
| A. | SO2、NO、CO、烟尘 | B. | CO2、Cl2、N2、雾 | C. | HCl、NO2、N2、粉尘 | D. | CO2、NO、NH3、H2S |
18.把6mol气体A和5mol气体B通入容积为4L的密闭容器中,在一定条件下发生如下反应:3A(g)+B(g)?2C(g)+xD(g)(正反应放热),5min达平衡,此时生成2molC,测得D的平均反应速率为0.1mol•L-1•min-1.下列说法中正确的是( )
| A. | A的平均反应速率为0.15mol•L-1•min-1 | |
| B. | 恒温下达到平衡的标志是C和A的生成速率相等 | |
| C. | 降低平衡体系的温度,逆反应速率变小,正反应速率增大 | |
| D. | B的转化率为25% |
8.设 NA 为阿伏加德罗常数的数值,下列说法错.误.的是( )
| A. | 一定条件下,2molSO2 和 1molO2 混合在密闭容器中充分反应后容器中的分子数大于2NA | |
| B. | 256g S8 分子中含 S-S 键为 7NA 个 | |
| C. | 由 1molCH3COONa 和少量 CH3COOH 形成的中性溶液中,CH3COO-数目为 NA 个 | |
| D. | 1 mol Na 与 O2 完全反应,生成 NaO2 和 Na2O2的混合物,转移电子总数为 NA 个 |
12.短周期元素a、b、c、d原子序数依次增大.a的核外电子总数与其周期数相同,b的某种单质是空气的主要成分,c的最外层电子数为其内层电子数的3倍,d与c同族;下列说法错误的是( )
| A. | a、b、d均可以与c形成两种或多种二元化合物 | |
| B. | 阴离子的还原性d大于c | |
| C. | a与d形成的化合物可以抑制水的电离 | |
| D. | 常温下,由这四种元素构成的某种盐的溶液pH=4,则水电离出的H+浓度肯定是1×10-4mol/L |
13.在0.1mol•L-1的NaHCO3溶液中,下列关系正确的是( )
| A. | c(Na+)>c(HCO3-)>c(H+)>c(OH-) | B. | c(Na+)=c(HCO3-)>c(OH-)>c(H+) | ||
| C. | c(Na+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-) | D. | c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-) |
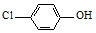 )的废水可以利用微生物电池除去,其原理如图1所示.
)的废水可以利用微生物电池除去,其原理如图1所示.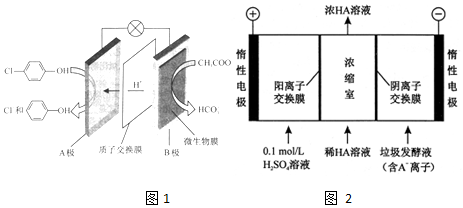
 -OH+2e-+H+═
-OH+2e-+H+═ -OH+Cl-
-OH+Cl-

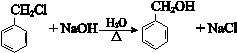 .
.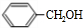 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2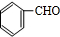 +2H2O.
+2H2O. .
.