题目内容
13.对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施.(1)含氰废水中的CN-有剧毒.
①CN-中C元素显+2价,N元素显-3价,用原子结构解释N元素显负价的原因是C和N的原子电子层数相同(同周期),核电荷数C小于N,原子半径C大于N,吸引电子能力C弱于N
②在微生物的作用下,CN-能够被氧气氧化成HCO3-,同时生成NH3,该反应的离子方程式为2CN-+4H2O+O2$\frac{\underline{\;微生物\;}}{\;}$2HCO3-+2NH3.
(2)含乙酸钠和对氯酚(
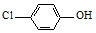 )的废水可以利用微生物电池除去,其原理如图1所示.
)的废水可以利用微生物电池除去,其原理如图1所示.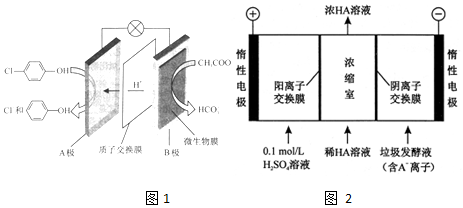
①B是电池的负 极(填“正”或“负”);
②A极的电极反应式为Cl-
 -OH+2e-+H+═
-OH+2e-+H+═ -OH+Cl-
-OH+Cl-(3)电渗析法处理厨房垃圾发酵液,同时得到乳酸的原理如图2所示(图中“HA”表示乳酸分子,A-表示乳酸根离子).
①阳极的电极反应式为4OH--4e-═2H2O+O2↑
②简述浓缩室中得到浓乳酸的原理:阳极OH-放电,c(H+)增大,H+从阳极通过阳离子交换膜进入浓缩室,A-通过阴离子交换膜从阴极进入浓缩室,H++A-═HA,乳酸浓度增大
③电解过程中,采取一定措施可控制阳极室pH约为6-8,此时进入浓缩室的OH-可忽略不计.
400mL 10g•g•L-1乳酸溶液通电一段时间后,浓度上升为145g•g•L-1(溶液体积变化忽略不计),阴极上产生的H2在标准状况下的体积约为6.72L.(乳酸的摩尔质量为90g•mol-1)
分析 (1)①根据元素周期律结合原子半径的大小和得电子能力大小来判断;
②根据信息:CN-能够被氧气氧化成HCO3-,同时生成NH3来书写方程式;
(2)①根据原电池中阳离子的移动方向确定正负极;
②根据电解池的工作原理结合电极反应来回答判断;
(3)①阳极上氢氧根离子失电子生成氧气;
②根据电解池中离子的移动以及发生的反应H++A-═HA判断;
③根据电极反应式结合原子守恒来计算.
解答 解:(1)①C和N是第二周期元素的原子,它们的原子电子层数相同(同周期),但是核电荷数C小于N,所以原子半径C大于N,即吸引电子能力C弱于N,所以C、N形成的化合物共用电子对偏向N原子,N元素显负价,
故答案为:C和N的原子电子层数相同(同周期),核电荷数C小于N,原子半径C大于N,吸引电子能力C弱于N;
②CN-能够被氧气氧化成HCO3-,同时生成NH3得出方程式为:2CN-+4H2O+O2$\frac{\underline{\;微生物\;}}{\;}$2HCO3-+2NH3,
故答案为:2CN-+4H2O+O2$\frac{\underline{\;微生物\;}}{\;}$2HCO3-+2NH3;
(2)①原电池中氢离子的移动方向是从负极流向正极,所以B是电池的负极,
故答案为:负;
②A是正极,正极上发生得电子的还原反应:Cl- -OH+2e-+H+═
-OH+2e-+H+═ -OH+Cl-,
-OH+Cl-,
故答案为:Cl- -OH+2e-+H+═
-OH+2e-+H+═ -OH+Cl-;
-OH+Cl-;
(3)①阳极上是阴离子氢氧根离子发生失电子的氧化反应,电极反应式为:4OH--4e-═2H2O+O2↑,
故答案为:4OH--4e-═2H2O+O2↑;
②在电解池的阳极上是OH-放电,所以c(H+)增大,并且H+从阳极通过阳离子交换膜进入浓缩室;根据电解原理,电解池中的阴离子移向阳极,即A-通过阴离子交换膜从阴极进入浓缩室,这样:H++A-═HA,乳酸浓度增大,
故答案为:阳极OH-放电,c(H+)增大,H+从阳极通过阳离子交换膜进入浓缩室,A-通过阴离子交换膜从阴极进入浓缩室,H++A-═HA,乳酸浓度增大;
③在阳极上发生电极反应:4OH--4e-═2H2O+O2↑,阴极上发生电极反应:2H++2e-=H2↑,根据电极反应方程式,则有:HA~H+~$\frac{1}{2}$H2,根据差值法,乳酸的浓度变化量是$\frac{145g•{L}^{-1}-10g•{L}^{-1}}{90g/mol}$=1.5mol/L,即生成HA的物质的量是1.5mol/L×0.4L=0.6mol,所以产生氢气是0.3mol即0.3mol×22.4L/mol=6.72L,
故答案为:6.72.
点评 本题涉及电解池和原电池的工作原理以及应用的考查,注意知识的迁移和应用,难度中等,明确原电池和电解池中电极反应时解题的关键,侧重于考查学生的分析能力和计算能力.

| 选项 | 现象或事实 | 解释 |
| A | 明矾可用作净水剂 | 明矾能水解生成Al(OH)3 胶体 |
| B | FeCl3溶液可用于腐蚀铜制印刷电路 | FeCl3 溶液能与Cu反应 |
| C | SO2可用于漂白纸浆 | SO2 具有氧化性 |
| D | 酸性或碱性表示食物不宜放在铝锅中久置 | 铝能与酸或碱反应 |
| A. | A | B. | B | C. | C | D. | D |
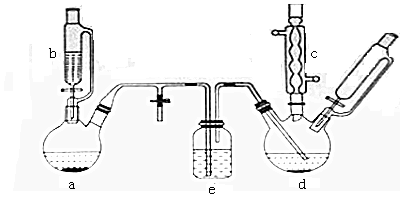
请回答下列问题:
(1)仪器a中盛有KMnO4晶体,仪器b中盛有浓盐酸.打开仪器b中的活塞,使浓盐酸缓缓滴下,可观察到仪器a内的现象是有黄绿色气体生成,用离子方程式表示产生该现象的原因:2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O.
(2)仪器b外侧玻璃导管的作用是使浓盐酸能顺利滴下(或答“平衡仪器a、b内的气压”).
(3)仪器d内盛有苯,FeCl3粉末固体,仪器a中生成的气体经过仪器e进入到仪器d中.
①仪器e的名称是洗气瓶,其盛装的试剂名称是浓硫酸.
②仪器d中的反应进行过程中,保持温度在40~60℃,以减少副反应发生.仪器d的加热方式最好是水浴加热,其优点是受热均匀,易于控制温度.
(4)仪器c的作用是冷凝、回流.
(5)该方法制备的氯苯中含有很多杂质,工业生产中,通过水洗除去FeCl3,HCl及部分Cl2,然后通过碱洗除去Cl2;碱洗后通过分液得到含氯苯的有机物混合物,混合物成分及沸点如表一:
表一
| 有机物 | 苯 | 氯苯 | 邻二氯苯 | 间二氯苯 | 对二氯苯 |
| 沸点/℃ | 80 | 132.2 | 180.4 | 173.0 | 174.1 |
(6)实际工业生产中,苯的流失如表二:
表二:
| 流失项目 | 蒸气挥发 | 二氯苯 | 其他 | 合计 |
| 苯流失量(kg/I) | 28.8 | 14.5 | 56.7 | 100 |
| A. | 质量相等的O2和O3中所含原子数相等 | |
| B. | 物质的量相等的O2和O3中所含分子数相等 | |
| C. | 物质的量相等的CO和CO2中所含原子数相等 | |
| D. | 物质的量相等的CO和CO2中所含碳原子数相等 |
| A. | 光化学烟雾 | B. | 水体富营养化 | C. | 臭氧空洞 | D. | 酸雨 |
| A. | Li、Be、B原子最外层电子数依次增多 | |
| B. | P、S、Cl元素的最高正价依次升高 | |
| C. | Li、Na、K的金属性依次减弱 | |
| D. | N、O、F原子半径依次增大 |
| A. | 分子总数为NA的NO2和CO2的混合气体中含有的氧原子数为2NA | |
| B. | 相同物质的量的CO与CO2 含有碳原子数相同 | |
| C. | 标准状况下,14 g氮气含有的核外电子数为7NA | |
| D. | 标准状况下,5.6 L四氯化碳含有的分子数为0.25NA |
| A. | 2 | B. | 8 | C. | 16 | D. | 18 |