题目内容
20.已知t℃时,Ksp[Al(OH)3]=l×l0-33,Ksp[Mg(OH)2]=4×10-12.在含有0.20mol/L H+且c(Mg2+)=c(A13+)=0.10mol/L的溶液中不断加入KOH溶液,沉淀的质量m(沉淀)与加入KOH溶液的体积V[KOH(aq)]关系的示意图正确的是( )| A. |  | B. |  | ||
| C. |  | D. | 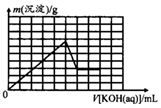 |
分析 根据题意加入的OH-先后分别与H+、Al3+、Mg2+反应,当Mg2+完全沉淀为Mg(OH)2时,过量的OH-再溶解Al(OH)3沉淀.溶液中H+几乎反应完,根据每消耗1 molOH-生成Al(OH)3和Mg(OH)2的质量分别为26g和29g,因此两条直线的斜率不同,生成Al(OH)3的斜率小些,生成Mg(OH)2的斜率较大.
解答 解:加入的OH-先后分别与H+、Al3+、Mg2+反应,当Mg2+完全沉淀为Mg(OH)2时,过量的OH-再溶解Al(OH)3沉淀.溶液中H+几乎反应完,根据每消耗1 molOH-生成Al(OH)3和Mg(OH)2的质量分别为26 g和29 g,因此两条直线的斜率不同,生成Al(OH)3的斜率小些,生成Mg(OH)2的斜率较大,B、D图象起点错误,C图象OH-先后分别与Al3+、Mg2+反应生成沉淀的斜率一样错误,故选A.
点评 本题考查离子反应的计算,把握图象中发生的离子反应及反应的先后顺序为解答的关键,侧重分析与计算能力的考查,题目难度中等.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案
相关题目
10.A、B、D、E、F为短周期元素.非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍.B在D中充分燃烧能生成其最高价化合物BD2.E+与D2-具有相同的电子数.A在F中燃烧,产物溶于水得到一种强酸.回答下列问题:
(1)写出工业制备单质F的离子方程式2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑.
(2)B、D、E组成的一种盐中,E的质量分数为43%,其水溶液与F单质反应的化学方程式为2Na2CO3+Cl2+H2O═NaCl+NaClO+2NaHCO3.
(3)由这些元素组成的物质,其组成和结构信息如下表:
a的化学式为NaH;b的化学式为Na2O2;c的电子式为 ;d的晶体类型是金属.
;d的晶体类型是金属.
(1)写出工业制备单质F的离子方程式2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑.
(2)B、D、E组成的一种盐中,E的质量分数为43%,其水溶液与F单质反应的化学方程式为2Na2CO3+Cl2+H2O═NaCl+NaClO+2NaHCO3.
(3)由这些元素组成的物质,其组成和结构信息如下表:
| 物质 | 组成和结构信息 |
| a | 含有A的二元离子化合物 |
| b | 含有非极性共价键的二元离子化合物,且原子数之比为1:1 |
| c | 化学组成为BDF2 |
| d | 只存在一种类型作用力且可导电的单质晶体 |
 ;d的晶体类型是金属.
;d的晶体类型是金属.
12.设NA为阿伏伽德罗常数的值.下列有关叙述正确的是( )
| A. | 标况下,11.2L 氟化氢中含有的分子数目为0.5NA | |
| B. | 室温下,21.0g乙烯和丁烯的混合气体中所含的碳原子数目是NA | |
| C. | 室温下,2L0.05mol/L 的NH4NO3溶液中所含有的氮原子数目是0.2NA | |
| D. | 22.4L Cl2 与足量NaOH溶液反应时转移的电子数为NA |
9.下列物质组合中,既能和酸反应又能和碱反应的化合物是( )
①Al ②Al2O3 ③Al(OH)3 ④NaHCO3 ⑤(NH4)2CO3.
①Al ②Al2O3 ③Al(OH)3 ④NaHCO3 ⑤(NH4)2CO3.
| A. | ①②③④⑤ | B. | ②③④⑤ | C. | ①③④ | D. | ①②④⑤ |
10.在酸性条件下H2C2O4可以被KMnO4溶液氧化,使KMnO4溶液褪色,依据KMnO4溶液褪色时间的长短可以比较反应进行的快慢.下列各组实验中溶液褪色最快的是( )
| 组号 | 反应温度 /℃ | 参加反应物质 | ||||
| KMnO4 | H2C2O4 | MnSO4 | ||||
| V/mL | c/mol•L-1 | V/mL | c/mol•L-1 | m/g | ||
| A | 20 | 4 | 0.1 | 2 | 0.1 | 0 |
| B | 20 | 4 | 0.1 | 2 | 0.1 | 0.1 |
| C | 40 | 4 | 0.1 | 2 | 0.1 | 0 |
| D | 40 | 4 | 0.1 | 2 | 0.2 | 0.1 |
| A. | A | B. | B | C. | C | D. | D |
 .
.