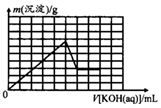
题目内容
5.已知A、B、C、D、E是原子序数依次增大的五种短周期元素,A与C同主族,A与B、A与E形成共价化合物,A与B形成的最简单化合物的水溶液呈碱性,E的最高正化合价与最低负化合价的代数和为6,D是同周期中简单离子半径最小的元素.(1)五种元素中,E在元素周期表中的位置是第3周期ⅦA族.
(2)B的气态氢化物与其最高价氧化物对应的水化物反应生成的化合物中存在的化学键类型为离子键和共价键.
(3)C的最高价氧化物对应的水化物与D的最高价氧化物反应的化学方程式为Al2O3+2NaOH═2NaAlO2+H2O.
(4)写出由A、B元素形成的六核分子的电子式
 .
.(5)已知X、Y、Z三种物质中均含有上述元素中的某一种元素,它们之间存在如图所示的转化关系:X$\stackrel{W}{→}$Y$?_{X}^{W}$Z
①X、Y、Z均含有同一种金属元素,若W固体俗称干冰,则反应Y→Z的离子方程式为CO32-+CO2+H2O═2HCO3-;若W是强碱,且Y是白色难溶固体,则反应Y→Z的离子方程式为Al(OH)3+OH-═AlO2-+2H2O.
②X、Y、Z是均含有同一种非金属元素的化合物,W是一种常见金属单质,且上述转化均在常温条件下完成,则反应Z→Y的离子方程式为3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O.
分析 A、B、C、D、E是原子序数依次增大的五种短周期元素,A与B形成的最简单化合物的水溶液呈碱性,A为H,B为N元素;A与C同主族,C为Na元素;A与B、A与E形成共价化合物,E的最高正化合价与最低负化合价的代数和为6,E为Cl元素,D是同周期中简单离子半径最小的元素,D为第三周期元素,则D为Al,以此解答(1)~(4);
(5)由转化关系:X$\stackrel{W}{→}$Y$?_{X}^{W}$Z
①X、Y、Z均含有同一种金属元素,若W固体俗称干冰,W为CO2,X为NaOH,Y为碳酸钠,Z为碳酸氢钠;若W是强碱,且Y是白色难溶固体,X为氯化铝,Y为氢氧化铝,Z为偏铝酸钠;
②X、Y、Z是均含有同一种非金属元素的化合物,W是一种常见金属单质,X为硝酸,Y为硝酸铁,Z为硝酸亚铁.
解答 解:由上述分析可知,A为H,B为N,C为Na,D为Al,E为Cl,
(1)E在元素周期表中的位置是第3周期ⅦA族,故答案为:第3周期ⅦA族;
(2)B的气态氢化物与其最高价氧化物对应的水化物反应生成的化合物为硝酸铵,含离子键和共价键,故答案为:离子键和共价键;
(3)C的最高价氧化物对应的水化物与D的最高价氧化物反应的化学方程式为Al2O3+2NaOH═2NaAlO2+H2O,故答案为:Al2O3+2NaOH═2NaAlO2+H2O;
(4)由A、B元素形成的六核分子的电子式为 ,故答案为:
,故答案为: ;
;
(5)①X、Y、Z均含有同一种金属元素,若W固体俗称干冰,W为CO2,X为NaOH,Y为碳酸钠,Z为碳酸氢钠,则反应Y→Z的离子方程式为CO32-+CO2+H2O═2HCO3-;若W是强碱,且Y是白色难溶固体,X为氯化铝,Y为氢氧化铝,Z为偏铝酸钠,则反应Y→Z的离子方程式为Al(OH)3+OH-═AlO2-+2H2O,
故答案为:CO32-+CO2+H2O═2HCO3-;Al(OH)3+OH-═AlO2-+2H2O;
②X、Y、Z是均含有同一种非金属元素的化合物,W是一种常见金属单质,X为硝酸,Y为硝酸铁,Z为硝酸亚铁,则反应Z→Y的离子方程式为3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O,故答案为:3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O.
点评 本题综合考查无机物的推断及原子结构与元素周期律,为高频考点,把握原子结构、元素的性质、元素化合物知识为解答的关键,侧重分析与推断能力的考查,综合性较强,题目难度中等.

 计算高手系列答案
计算高手系列答案(1)提出问题:Fe3+、Br2谁的氧化性更强?
(2)猜想
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致.则溶液呈黄色是含Br2(填化学式或离子符号,下同)所致.
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含Fe3+所致.
(3)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的.供选用的试剂:
A.酚酞试液 B.四氯化碳 C.无水酒精 D.硫氰化钾溶液
请写出丙同学的一种方案,选用的试剂及实验现象填在下表空格中.(试剂填序号)
| 选用试剂 | 实验现象 | |
| 方案 | ①d或b | ②溶液变成血红色或下层的四氯化碳溶液依然无色 |
①在少量FeBr2溶液中通入足量Cl2,反应的离子方程式为2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-
②在100mLFeBr2溶液中通入2.24LCl2(标准状况),溶液中有$\frac{1}{3}$的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为1.2mol/L.
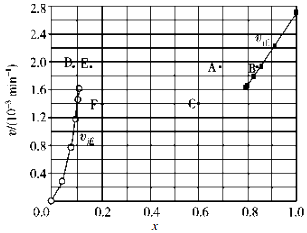 (1)已知反应 2HI(g)?H2(g)+I2(g)的△H=+11kJ/mol,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1mol HI(g)分子中化学键断裂时需吸收的能量为299kJ.
(1)已知反应 2HI(g)?H2(g)+I2(g)的△H=+11kJ/mol,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1mol HI(g)分子中化学键断裂时需吸收的能量为299kJ.(2)Bodensteins 研究了下列反应:2HI(g)?H2(g)+I2(g)在 716K 时,气体混合物中碘化氢的物质的量分数 x(HI)与反应时间 t 的关系如表:
| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
②上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为$\frac{{K}_{正}}{K}$(以K和k正表示).若 k正=0.0027min-1,在 t=40min 时,v正=1.95×10-3 min-1.
③由上述实验数据计算得到v正~x(HI)和 v逆~x(H2)的关系如图所示.当升高到某一温度时,反应重新达到平衡,相应的点依次为A(填字母)和E(填字母).
| A. | 乙酸的实验式CH2O | B. | 羟基电子式 | ||
| C. | 醛基的结构简式-COH | D. | 3,3-二甲基-1-戊烯的键线式 |
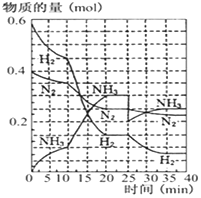 德国人发明了合成氨反应,其原理为:N2(g)+3H2(g)?2NH3(g);已知298K时,△H=-92.4kJ•mol-1,在500℃,20Mpa时,将氮气和氢气通入到体积为2升的密闭容器中,反应过程中各种物质的量变化如右图所示.
德国人发明了合成氨反应,其原理为:N2(g)+3H2(g)?2NH3(g);已知298K时,△H=-92.4kJ•mol-1,在500℃,20Mpa时,将氮气和氢气通入到体积为2升的密闭容器中,反应过程中各种物质的量变化如右图所示.