题目内容
19.设NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | 22g N2O和CO2的混合物中所含电子数为11NA | |
| B. | 12g石墨烯(单层石墨)中含有C-C键的数目为3NA | |
| C. | 与铁反应时,消耗22.4L(标准状况)Cl2转移的电子数定为3NA | |
| D. | 若1L 0.2mol•L-1的FeCl3溶液完全水解形成胶体,则胶休微粒数为0.2NA |
分析 A.N2O和CO2分子的摩尔质量相同,二者分子中都含有22个电子,据此计算出含有电子数;
B.在石墨晶体中1个C原子对应3×$\frac{1}{3}$=$\frac{3}{2}$个C-C键;
C.标准状况下22.4L氯气的物质的量为1mol,1mol氯气完全反应最多得到2mol电子;
D.氢氧化铁胶粒为氢氧化铁的聚集体.
解答 解:A.22g N2O和CO2的混合物中含有气体的物质的量为:$\frac{22g}{44g/mol}$=0.5mol,0.5mol混合气体中含有电子的物质的量为:0.5mol×22=11mol,所含电子数为11NA,故A正确;
B.在石墨晶体中1个C原子对应3×$\frac{1}{3}$=$\frac{3}{2}$个C-C键,12 g石墨的物质的量为:$\frac{12g}{12g/mol}$=1mol,则12g石墨中含有C-C键的物质的量为:1mol×$\frac{3}{2}$=1.5mol,含有碳氢键个数为1.5NA,故B错误;
C.标准状况下22.4L氯气的物质的量为:$\frac{22.4L}{22.4L/mol}$=1mol,1mol氯气与Fe完全反应最多得到2mol电子,转移的电子数定为2NA,故C错误;
D.若1L 0.2mol•L-1的FeCl3溶液完全水解形成胶体,由于氢氧化铁胶粒为氢氧化铁的聚集体,则胶体中微粒数小于0.2NA,故D错误;
故选A.
点评 本题考查阿伏加德罗常数的计算与判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,B为难点、易错点,注意明确均摊法的应用,试题培养了学生的化学计算能力.

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
11.下列反应中,不属于HNO3类别通性的是( )
| A. | 4HNO3(浓)+S$\frac{\underline{\;\;△\;\;}}{\;}$SO2↑+4NO2↑+2H2O | B. | HNO3+NaOH=NaNO3+H2O | ||
| C. | 2HNO3+CuO=Cu(NO3)2+H2O | D. | 2HNO3+CaCO3=Ca(NO3)2+CO2↑+H2O |
12.下列化工生产过程中,未涉及氧化还原反应的是( )
| A. | 侯式制碱法制纯碱 | B. | 海带提碘 | ||
| C. | 氯碱工业 | D. | 海水提溴 |
4.下列关于Na2CO3和NaHCO3性质的叙述中,不正确的是( )
| A. | 加入澄清石灰水都有白色沉淀生成 | |
| B. | 向NaOH溶液中通入过量的CO2可制得NaHCO3 | |
| C. | 向饱和Na2CO3溶液中通入足量的CO2没有明显现象 | |
| D. | 可利用稀盐酸来区别Na2CO3、NaHCO3两种无色溶液 |
11.下列关于物质的量浓度表述正确的是( )
| A. | 0.3mol•L-1 的Na2SO4溶液中含有Na+和SO42-的总物质的量为0.9mol | |
| B. | 当1L水吸收22.4L氨气时所得氨水的浓度不是1mol•L-1,只有当22.4L氨气溶于水制得1L氨水时,其浓度是1mol•L-1 | |
| C. | 在K2SO4和NaCl的混合溶液中,如果Na+和SO42-的物质的量相等,则K+和Cl-的物质的量浓度一定相同 | |
| D. | 250g胆矾溶于水得到1L溶液,所得CuSO4溶液的物质的量浓度为1mol•L-1 |
8.某无色溶液能与铝作用生成氢气,则溶液中可能大量共存的离子组是:( )
| A. | H+、Ba2+、Mg2+、Cl- | B. | Cl-、CO32-、Cu2+、Mg2+ | ||
| C. | NO3-、SO42-、K+、H+ | D. | NO3-、OH-、Ba2+、Cl- |
9.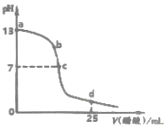 如图为常温下0.2000mol•L-1 CH3COOH溶液逐滴加入到25mL0.1000mol•L-1 NaOH溶液中pH的变化曲线,下列说法不正确的是( )
如图为常温下0.2000mol•L-1 CH3COOH溶液逐滴加入到25mL0.1000mol•L-1 NaOH溶液中pH的变化曲线,下列说法不正确的是( )
 如图为常温下0.2000mol•L-1 CH3COOH溶液逐滴加入到25mL0.1000mol•L-1 NaOH溶液中pH的变化曲线,下列说法不正确的是( )
如图为常温下0.2000mol•L-1 CH3COOH溶液逐滴加入到25mL0.1000mol•L-1 NaOH溶液中pH的变化曲线,下列说法不正确的是( )| A. | a~c区间内(不包含a、c两点)可能存在:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| B. | c点时溶液中:c(Na+)=c(CH3COO-) | |
| C. | d点时溶液中:c(Na+)+c(H+)+c(CH3COO-)-c(OH-)=0.2000mol•L-1 | |
| D. | 反应过程中溶液中阴、阳离子总数:b点小于c点 |