题目内容
12.下列化工生产过程中,未涉及氧化还原反应的是( )| A. | 侯式制碱法制纯碱 | B. | 海带提碘 | ||
| C. | 氯碱工业 | D. | 海水提溴 |
分析 含元素化合价变化的反应为氧化还原反应,以此来解答.
解答 解:A.侯式制碱法制纯碱中二氧化碳、氨气、氯化钠反应生成碳酸氢钠和氯化铵,碳酸氢钠受热分解转化为碳酸钠,二氧化碳和水,均没有元素的化合价变化,则不涉及氧化还原反应,故A选;
B.海带提碘是由碘离子变为I2,有元素化合价的变化,属于氧化还原反应,故B不选;
C.氯碱工业中电解食盐水生成氢气、氯气,H、Cl元素的化合价变化,为氧化还原反应,故C不选;
D.海水中溴以离子存在,与氧化剂发生氧化还原反应生成溴单质,有元素化合价的变化,属于氧化还原反应,故D不选;
故选A.
点评 本题考查氧化还原反应,为高频考点,把握发生的反应及反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应的判断,题目难度不大.

练习册系列答案
相关题目
3.下列实验不合理的是( )


| A. | 用浓硫酸干燥SO2,选③ | |
| B. | 从食盐溶液中获取NaCl,选② | |
| C. | 除去自来水中的Cl-,制纯净水,选④和① | |
| D. | 除去Fe(OH)3胶体中的难溶物,选④ |
20.在标准状况下,下列物质体积最大的是( )
| A. | 3 g氢气 | B. | 6.02×1023个氢分子 | ||
| C. | 44.8 L氢气 | D. | 0.5 mol氢气 |
7.配制某植物营养液可补充氮、磷、钾元素,其成分及含量如表所示:
(1)补充钾元素的物质是K2SO4,其电离方程式为K2SO4═2K++SO42-.
(2)该营养液若在碱性土壤使用,会使氮肥肥效降低,其原因是NH4++OH-═NH3•H2O.
(3)该营养液中磷元素的浓度为3×10-3mol/L.
| 成分 | 含量 (mg/L) |
| 硝酸钙 | 260 |
| 硫酸钾 | 250 |
| 磷酸二氢铵 (NH4H2PO4) M=115g/mol | 345 |
| 硫酸镁 | 537 |
| 硫酸铵 | 237 |
(2)该营养液若在碱性土壤使用,会使氮肥肥效降低,其原因是NH4++OH-═NH3•H2O.
(3)该营养液中磷元素的浓度为3×10-3mol/L.
2.某课外小组设计实验制取乙酸乙酯的装置如图所示,下列说法正确的是( )(填选项字母)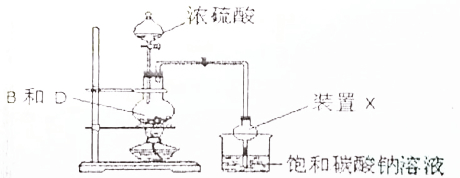

| A. | 反应中浓硫酸的作用是催化剂、吸水剂 | |
| B. | 饱和碳酸钠溶液可用饱和氢氧化钠溶液代替 | |
| C. | 实验结束后烧杯中的溶液经震荡、静置、分液,能得到纯净的乙酸乙酯 | |
| D. | 装置X的作用能防止倒吸 |
19.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 22g N2O和CO2的混合物中所含电子数为11NA | |
| B. | 12g石墨烯(单层石墨)中含有C-C键的数目为3NA | |
| C. | 与铁反应时,消耗22.4L(标准状况)Cl2转移的电子数定为3NA | |
| D. | 若1L 0.2mol•L-1的FeCl3溶液完全水解形成胶体,则胶休微粒数为0.2NA |
20.下列叙述正确的是( )
| A. | 呈酸性的雨水通常称为酸雨 | |
| B. | 翡翠、玛瑙、水晶等饰物都是硅酸盐制品 | |
| C. | 合金材料一定全部由金属元素组成 | |
| D. | 硅是制作太阳能电池的主要原料 |