题目内容
8.某无色溶液能与铝作用生成氢气,则溶液中可能大量共存的离子组是:( )| A. | H+、Ba2+、Mg2+、Cl- | B. | Cl-、CO32-、Cu2+、Mg2+ | ||
| C. | NO3-、SO42-、K+、H+ | D. | NO3-、OH-、Ba2+、Cl- |
分析 无色溶液能与铝作用生成氢气,为非氧化性酸或强碱溶液,根据离子之间不能结合生成水、气体、沉淀等,则离子大量共存,并结合离子的颜色来解答.
解答 解:A.如为酸性,离子之间不发生任何反应,可大量共存,故A正确;
B.酸性条件下,CO32-不能大量共存,碱性条件下Cu2+、Mg2+不能大量共存,故B错误;
C.酸溶液中Al、H+、NO3-发生氧化还原反应不生成氢气,碱溶液中不能存在H+,故C错误;
D.碱性条件下,离子之间不发生任何反应,可大量共存,故D正确.
故选AD.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析能力及氧化还原反应、复分解反应的离子反应考查,题目难度不大.

练习册系列答案
相关题目
20.在标准状况下,下列物质体积最大的是( )
| A. | 3 g氢气 | B. | 6.02×1023个氢分子 | ||
| C. | 44.8 L氢气 | D. | 0.5 mol氢气 |
19.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 22g N2O和CO2的混合物中所含电子数为11NA | |
| B. | 12g石墨烯(单层石墨)中含有C-C键的数目为3NA | |
| C. | 与铁反应时,消耗22.4L(标准状况)Cl2转移的电子数定为3NA | |
| D. | 若1L 0.2mol•L-1的FeCl3溶液完全水解形成胶体,则胶休微粒数为0.2NA |
16.如图是电解熔融 NaCl 制备金属钠的装置示意图,下列有关判断正确的是( )
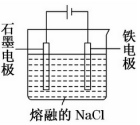

| A. | 通过该装置可以将化学能转化为电能 | |
| B. | 石墨电极为正极 | |
| C. | Na+在铁电极上得到电子被还原为钠 | |
| D. | 电流从负极流出,流入铁电极 |
3.下列陈述Ⅰ、Ⅱ均正确且有因果关系的是( )
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | SiO2有导电性 | SiO2可用于制备光导纤维 |
| B | Fe3+有氧化性 | FeCl3溶液可溶解废旧电路中的铜 |
| C | NH3有还原性 | NH3可用H2SO4吸收 |
| D | 浓HNO3有酸性 | 浓HNO3不可用贴铁容器盛放 |
| A. | A | B. | B | C. | C | D. | D |
13.已知X、Y、Z、W(含同一元素)有如图所示的转化关系,若X是一种单质,W为一种含氧酸,则X不可能是( )

| A. | Na | B. | S | C. | C | D. | Si |
20.下列叙述正确的是( )
| A. | 呈酸性的雨水通常称为酸雨 | |
| B. | 翡翠、玛瑙、水晶等饰物都是硅酸盐制品 | |
| C. | 合金材料一定全部由金属元素组成 | |
| D. | 硅是制作太阳能电池的主要原料 |
17.下列指定反应的离子方程式正确的是( )
| A. | 用铁电极电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| B. | 用强碱溶液吸收工业制取硝酸的尾气:NO+NO2+2OH-=2NO${\;}_{3}^{-}$+H2O | |
| C. | 向硫酸铜溶液中加入NaHS溶液生成黑色沉淀:Cu2++HS-=CuS↓+H+ | |
| D. | 向Al2(SO4)3溶液中加入过量氨水:Al3++4NH3•H2O=[Al(OH)4]-+4NH${\;}_{4}^{+}$ |