题目内容
14.将标况下的a L HCl(g)溶于1000g水中,得到的盐酸密度为b g/cm3,此时盐酸中Cl-浓度与AlCl3和NaCl的混合液中的Cl-浓度相同,已知混合液中Na+的浓度为c mol/L,则混合液中Al3+的浓度是$\frac{1}{3}$($\frac{1000ab}{22400+36.5a}$-c)mol/L.分析 根据n=$\frac{V}{{V}_{m}}$计算HCl的物质的量,再根据溶液的质量、密度求出溶液的体积,然后物质的量浓度公式计算溶液的物质的量浓度,从而可知氯离子的浓度;最后根据电荷守恒计算出铝离子的浓度.
解答 解:标准状况下aL HCl的物质的量为:$\frac{aL}{22.4L/mol}$=$\frac{a}{22.4}$mol,氯化氢的质量m=nM=$\frac{a}{22.4}$mol×36.5g/mol=$\frac{36.5a}{22.4}$g,所得盐酸溶液的体积为:V=$\frac{\frac{36.5a}{22.4}g+1000g}{1000bg•{L}^{-1}}$=$\frac{22400+36.5a}{22400b}$L,所得溶液浓度为:c(HCl)=$\frac{n}{V}$=$\frac{\frac{a}{22.4}mol}{\frac{22400+36.5a}{22400b}L}$=$\frac{1000ab}{22400+36.5a}$mol/L,
AlCl3和NaCl的混合液中的Cl-浓度与该盐酸的浓度相同,已知混合液中Na+的浓度为c mol/L,根据电荷守恒可知:c(Na+)+3c(Al3+)=c(Cl-)=$\frac{1000ab}{22400+36.5a}$mol/L,则c(Al3+)=$\frac{1}{3}$($\frac{1000ab}{22400+36.5a}$mol/L-cmol/L)=$\frac{1}{3}$($\frac{1000ab}{22400+36.5a}$-c)mol/L,
故答案为:$\frac{1}{3}$($\frac{1000ab}{22400+36.5a}$-c)mol/L.
点评 本题考查了物质的量浓度的计算,题目难度中等,正确计算盐酸的浓度为解答关键,注意掌握守恒思想在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.

 中考解读考点精练系列答案
中考解读考点精练系列答案| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 乙烷(乙烯) | 氢气 | 加热 |
| C | 乙醇(水) | 生石灰 | 蒸馏 |
| D | 苯(甲苯) | 蒸馏水 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
| 成分 | 含量 (mg/L) |
| 硝酸钙 | 260 |
| 硫酸钾 | 250 |
| 磷酸二氢铵 (NH4H2PO4) M=115g/mol | 345 |
| 硫酸镁 | 537 |
| 硫酸铵 | 237 |
(2)该营养液若在碱性土壤使用,会使氮肥肥效降低,其原因是NH4++OH-═NH3•H2O.
(3)该营养液中磷元素的浓度为3×10-3mol/L.
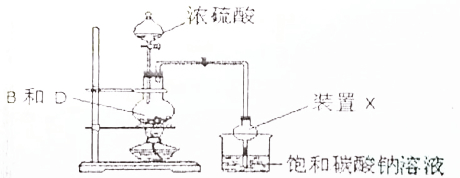
| A. | 反应中浓硫酸的作用是催化剂、吸水剂 | |
| B. | 饱和碳酸钠溶液可用饱和氢氧化钠溶液代替 | |
| C. | 实验结束后烧杯中的溶液经震荡、静置、分液,能得到纯净的乙酸乙酯 | |
| D. | 装置X的作用能防止倒吸 |
| A. | 22g N2O和CO2的混合物中所含电子数为11NA | |
| B. | 12g石墨烯(单层石墨)中含有C-C键的数目为3NA | |
| C. | 与铁反应时,消耗22.4L(标准状况)Cl2转移的电子数定为3NA | |
| D. | 若1L 0.2mol•L-1的FeCl3溶液完全水解形成胶体,则胶休微粒数为0.2NA |
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | SiO2有导电性 | SiO2可用于制备光导纤维 |
| B | Fe3+有氧化性 | FeCl3溶液可溶解废旧电路中的铜 |
| C | NH3有还原性 | NH3可用H2SO4吸收 |
| D | 浓HNO3有酸性 | 浓HNO3不可用贴铁容器盛放 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 向饱和碳酸钠溶液中通入二氧化碳:CO32-+CO2+H2O═2HCO3- | |
| B. | MnO2与浓盐酸反应制取Cl2:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2↑+2H2O | |
| C. | 亚硫酸氢钠溶液中加过量澄清石灰水:2HSO3-+Ca2++2OH-═CaSO3↓+2H2O+SO32- | |
| D. | 金属钠与硫酸铜溶液反应:2Na+2H2O+Cu2+═2Na++Cu(OH)2↓+H2↑ |