题目内容
7.实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用的时间来判断空气中的含汞量,其反应为:4CuI+Hg═Cu2HgI4+2Cu(1)上述反应产物Cu2HgI4中,Cu元素显+1价.
(2)以上反应中的氧化剂为CuI,当有1mol CuI发生反应时,转移电子0.5mol.
(3)用双线桥法表示反应中电子转移的方向和数目.
分析 反应4CuI+Hg═Cu2HgI4+2Cu中,Cu元素化合价部分由+1价降低到0价,被还原,CuI为氧化剂,Hg元素化合价由0价升高到+2价,Hg为还原剂,结合元素化合价的变化解答该题.
解答 解:(1)Cu2HgI4中Hg元素的化合价为+2价,I元素的化合价为-1价,则Cu元素的化合价为+$\frac{4×1-2}{2}$=+1价,
故答案为:+1;
(2)在反应4CuI+Hg═Cu2HgI4+2Cu中,CuI中Cu元素的化合价由+1价降为0价,为氧化剂,为氧化产物,1molCuI参加反应转移的电子为0.5mol,
故答案为:CuI;0.5;
(3)Cu元素化合价部分由+1价降低到0价,被还原,CuI为氧化剂,Hg元素化合价由0价升高到+2价,电子转移方向和数目可表示为 ,
,
故答案为: .
.
点评 本题考查氧化还原反应,为高考常见题型和高频考点,侧重于学生的分析能力的考查,注意从元素化合价的角度认识相关概念并把握物质的性质,题目难度不大.

练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目
19.下列化学用语不正确的是( )
| A. | 羟基电子式: | B. | 甲醛的结构式: | ||
| C. | 乙醇的结构简式:CH3CH2OH | D. | 1,3-丁二烯的分子式:C4H8 |
20.在标准状况下,下列物质体积最大的是( )
| A. | 3 g氢气 | B. | 6.02×1023个氢分子 | ||
| C. | 44.8 L氢气 | D. | 0.5 mol氢气 |
2.某课外小组设计实验制取乙酸乙酯的装置如图所示,下列说法正确的是( )(填选项字母)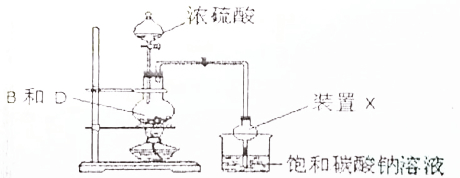

| A. | 反应中浓硫酸的作用是催化剂、吸水剂 | |
| B. | 饱和碳酸钠溶液可用饱和氢氧化钠溶液代替 | |
| C. | 实验结束后烧杯中的溶液经震荡、静置、分液,能得到纯净的乙酸乙酯 | |
| D. | 装置X的作用能防止倒吸 |
12.下列有关叙述正确的是( )
| A. | 电泳现象可证明胶体带电荷 | |
| B. | 直径在1~100mm之间的粒子称为胶体 | |
| C. | 是否具有丁达尔效应是溶液和胶体的本质区别 | |
| D. | 胶体粒子很小,可以透过滤纸 |
19.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 22g N2O和CO2的混合物中所含电子数为11NA | |
| B. | 12g石墨烯(单层石墨)中含有C-C键的数目为3NA | |
| C. | 与铁反应时,消耗22.4L(标准状况)Cl2转移的电子数定为3NA | |
| D. | 若1L 0.2mol•L-1的FeCl3溶液完全水解形成胶体,则胶休微粒数为0.2NA |
16.如图是电解熔融 NaCl 制备金属钠的装置示意图,下列有关判断正确的是( )
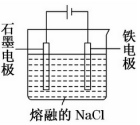

| A. | 通过该装置可以将化学能转化为电能 | |
| B. | 石墨电极为正极 | |
| C. | Na+在铁电极上得到电子被还原为钠 | |
| D. | 电流从负极流出,流入铁电极 |
17.下列指定反应的离子方程式正确的是( )
| A. | 用铁电极电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| B. | 用强碱溶液吸收工业制取硝酸的尾气:NO+NO2+2OH-=2NO${\;}_{3}^{-}$+H2O | |
| C. | 向硫酸铜溶液中加入NaHS溶液生成黑色沉淀:Cu2++HS-=CuS↓+H+ | |
| D. | 向Al2(SO4)3溶液中加入过量氨水:Al3++4NH3•H2O=[Al(OH)4]-+4NH${\;}_{4}^{+}$ |



